
【题目】第四周期中的18种元素具有重要的用途,在现代工业中备受青睐。
(1)铬是一种硬而脆、抗腐蚀性强的金属,常用于电镀和制造特种钢。基态 Cr 原子中,电子占据最高能层的符号为______,该能层上具有的原子轨道数为________,价电子排布式为 ____________。
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的,30Zn与31Ga 的第一电离能是否符合这一规律?________(填“是”或“否”),原因是____________(如果前一问填“是”,此问可以不答)。
(3)镓与第ⅤA 族元素可形成多种新型人工半导体材料,砷化镓(GaAs)就是其中一种,其晶体结构如下图所示(白色球代表 As 原子)。在 GaAs 晶体中,每个 Ga 原子与________个 As 原子相连,与同一个 Ga 原子相连的As原子构成的空间构型为________。

(4)铜单质晶体中原子的堆积方式如下图,已知铜晶胞参数为apm,NA为阿伏加德罗常数,请回答:

①晶体中铜原子的配位数为________,堆积方式为________________堆积。
②铜原子半径r=_________pm;铜晶体密度的计算式为 ______________ g/cm3(注:铜原子相对原子质量为64)。
③Cu 与 N 按3:1形成的某种化合物,该化合物能与稀盐酸剧烈反应,生成一种白色沉淀和一种全部由非金属元素组成的离子化合物,该反应的化学方程式为______________。
【答案】N 16 3d54s1 否 Zn的4s能级上有2个电子,处于全满状态,较稳定 4 正四面体 12 面心立方最密 ![]()
![]() Cu3N+4HCl=3CuCl+NH4Cl
Cu3N+4HCl=3CuCl+NH4Cl
【解析】
(1)基态Cr原子排布式为1s21s22p63s23p64d54s1,离核越远,能量越高,即基态Cr原子中,电子占据能量最高的能层为N;该能层有s、p、d、f能级,含有原子轨道数分别为1、3、5、7,共有16个原子轨道;Cr属于过渡元素,价电子包括最外层电子和次外层d能级,即Cr的价电子排布式为3d54s1;
(2)Zn的价电子排布式为3d104s2,4s能级上有2个电子,处于全满,较稳定,Ga的价电子排布式为4s24p1,因此它们的第一电离能不符合这一规律;
(3)根据晶胞结构,As位于顶点和面心,Ga位于由四个As原子形成四面体的体心,因此每个Ga原子与4个As原子相连,与同一个Ga原子相连的As原子构成的空间构型为正四面体形;
(4)①铜原子晶体类型为面心立方最密堆积,其配位数为12;
②面对角线的距离是铜原子半径的4倍,r(Cu)=![]() pm;晶胞中铜原子个数为8×1/8+6×1/2=4,晶胞的质量为4×64/NAg,晶胞的体积为(a×10-10)3cm3,根据密度的定义,得出晶胞的密度为
pm;晶胞中铜原子个数为8×1/8+6×1/2=4,晶胞的质量为4×64/NAg,晶胞的体积为(a×10-10)3cm3,根据密度的定义,得出晶胞的密度为![]() g/cm3;
g/cm3;
③该化合物化学式为Cu3N,组成离子化合物的元素都是非金属元素,即离子化合物为铵盐,该铵盐为NH4Cl,沉淀中含有Cu元素,因此有Cu3N+HCl→NH4Cl+X根据H原子守恒HCl系数为4,X中应含有3个Cu和3个Cl,即X为CuCl,方程式为 Cu3N+4HCl=3CuCl+NH4Cl。


科目:高中化学 来源: 题型:
【题目】m g氢气和n g氦气的下列说法中,正确的是
A.同温同压下,H2与He的体积比为m∶2n
B.同温同压下,若m=n,则H2与He的分子数之比为2∶1
C.同温同压下,同体积时,H2与He的质量比![]() >1
>1
D.同温同压下,H2与He的密度比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国成功研制的新型可充电 AGDIB电池(铝-石墨双离子电池)采用石墨、铝锂合金作为电极材料,以常规锂盐和碳酸酯溶剂为电解液。电池反应为:CxPF6+LiyAl=Cx+LiPE6+Liy-1Al。放电过程如图,下列说法正确的是

A. B为负极,放电时铝失电子
B. 充电时,与外加电源负极相连一端电极反应为:LiyAl-e-=Li++Liy-1Al
C. 充电时A电极反应式为Cx+PF6-﹣e-=CxPF6
D. 废旧 AGDIB电池进行“放电处理”时,若转移lmol电子,石墨电极上可回收7gLi
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各种说法中错误的是:
①化学反应除了生成新物质外,还伴随着能量的变化;②同温同压下,H2 (g)+Cl2 (g)==2HCl(g)在光照和点燃条件下的反应热ΔH不同;③为防治酸雨、降低工业废气,常用生石灰进行“钙基固硫”:CaO+SO2= CaSO3、2CaSO3+O2![]() 2CaSO3;④开发太阳能、风能、地热能、潮汐能等新能源,可减少雾霾、保护环境;⑤煤的气化和液化技术,可高效、清洁地利用煤;⑥从海水提镁的过程为:MgCl2(aq)
2CaSO3;④开发太阳能、风能、地热能、潮汐能等新能源,可减少雾霾、保护环境;⑤煤的气化和液化技术,可高效、清洁地利用煤;⑥从海水提镁的过程为:MgCl2(aq)![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
A. ①③④ B. ②⑥ C. ①④⑤ D. ③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现需要1 mol·L1NaOH溶液240 mL,实验室提供以下试剂用于溶液的配制:蒸馏水、NaOH固体、4mol·L1 NaOH溶液
(1)无论采用何种试剂进行配制,除烧杯、玻璃棒、胶头滴管外,至少还必须用到的一种玻璃仪器是___________,在使用该仪器前必须进行的操作是_________________。
(2)若用NaOH固体进行配制,需用托盘天平称取NaOH的质量为_______ g;如果用4 mol/L的NaOH溶液稀释配制,需用量筒量取________mL 4mol/LNaOH溶液。
(3)配制一定物质的量浓度的NaOH溶液时,造成所配制溶液浓度偏低的原因是(____)
A. 称量时 NaOH已经潮解
B. 定容时俯视容量瓶的刻度线
C. 向容量瓶中转移溶液时,容量瓶事先用蒸馏水洗涤过
D. 摇匀后发现凹液面低于刻度线,滴加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:mA(g)+nB(g) ![]() pC(g)+qD(g)(m、n、p、q均为化学计量数),根据图示曲线回答:
pC(g)+qD(g)(m、n、p、q均为化学计量数),根据图示曲线回答:

(1)正反应是___热反应。
(2)m+n___p+q(填“>”“<”或“=”)。
(3)若将纵坐标A的转化率换成A在平衡混合物中的质量分数,则逆反应是____ 热反应,m+n___p+q(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得到的正确结论是( )
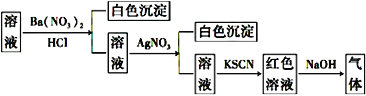
A. 原溶液中一定含有SO42-B. 原溶液中一定含有NH4+
C. 原溶液中一定含有Cl-D. 原溶液中一定含有Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【题目】已知:①H2(g)+ ![]() O2(g)=2H2O(g) △H1=akJ/mol
O2(g)=2H2O(g) △H1=akJ/mol
②2H2(g)+O2(g)=2H2O(g) △H2=b kJ/mol
③H2(g)+ ![]() O2(g)=H2O(l) △H3=ckJ/mol;
O2(g)=H2O(l) △H3=ckJ/mol;
④2H2(g)+O2(g)=2H2O(l) △H4=dkJ/mol。
下列关系正确的是
A. a<c<0 B. b>d>0 C. 2a=b<0 D. 2c=d>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com