
分析 (1)依据配制溶液的一般步骤选择缺少的操作步骤,依据溶液稀释过程中所含溶质的物质的量不变计算需要浓硫酸体积,依据浓硫酸体积选择合适规格的量筒;
(2)依据浓硫酸稀释的正确操作解答;
(3)分析操作对溶质的物质的量和溶液体积影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)配制溶液的一般步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶,所以缺少的第④步为冷却;
用18mol•L-1 浓硫酸配制100mL 3.0mol•L-1 稀硫酸,设需要浓硫酸体积为V,则依据溶液稀释过程中所含溶质的物质的量不变得:V×18mol/L=100mL×3.0mol/L,解得V=16.7mL,所以应选择25mL量筒;
故答案为:16.7mL;B;
(2)稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散;
故答案为:把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散;
(3)A.所用的浓硫酸长时间放置在密封不好的容器中,浓硫酸吸水浓度降低,量取的浓硫酸中硫酸的物质的量偏小,溶液浓度偏小;
B.容量瓶用蒸馏水洗涤后残留有少量的水,对溶质的物质的量和溶液体积都不产生影响,溶液浓度无影响;
C.所用过的烧杯、玻璃棒未洗涤,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏小;
D.定容时俯视刻度线单质溶液体积偏小,溶液浓度偏大;
故答案为:偏小;无影响;偏小;偏大.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及有关物质的浓度计算是解题关键,注意量筒规格的选择,注意浓硫酸稀释的正确操作,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | CH4和CH3CH2CH2CH3分子组成相差2个-CH2-,因此二者是同系物 | |
| B. | 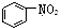 是芳香烃 是芳香烃 | |
| C. | 醇类的官能团是-CHO | |
| D. | 凡是含有碳元素的化合物都属于有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与水蒸气在高温下的反应产物为Fe2O3和H2 | |
| B. | 一定量的Fe与稀HNO3反应生成的盐中一定只有Fe(NO3)3 | |
| C. | 证明溶液中含Fe2+不含Fe3+的方法是先加KSCN溶液,溶液不变红色,然后加入氯水溶液变红色 | |
| D. | 除去FeCl2溶液中的FeCl3杂质可以向溶液中加入Cu粉,然后过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
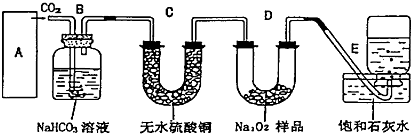

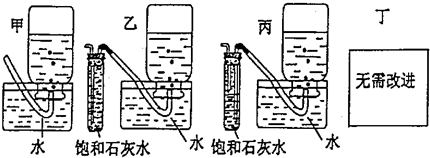
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
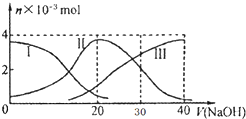 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液,含A元素的有关微粒物质的量变化如图所示.根据图示判断,下列说法正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液,含A元素的有关微粒物质的量变化如图所示.根据图示判断,下列说法正确的是( )| A. | H2A在水中的电离方程式是:H2A=H++HA-;HA-═H++A2- | |
| B. | 当V(NaOH)=20mL时,溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| C. | 当V(NaOH)=30mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)═c(A2-)+2 c(OH-) | |
| D. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
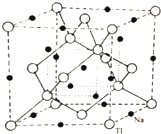 ⅢA族的硼、铝、镓、铟、铊等元素在化合物中通常表现出+3价,含ⅢA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题.
ⅢA族的硼、铝、镓、铟、铊等元素在化合物中通常表现出+3价,含ⅢA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

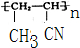
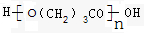
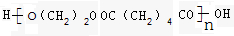 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com