
分析 淀粉和纤维素都属有机高分子化合物,其分子组成都可以用通式(C6H10O5)n表示,但二者的聚合度(n值)是不同的.它们都属于多糖,没有甜味,都不能发生发生银镜反应,都能发生水解反应最终生成葡萄糖.
解答 解:淀粉和纤维素都属有机高分子化合物,其分子组成都可以用通式(C6H10O5)n表示,但二者的聚合度(n值)是不同的.它们都属于多糖,没有甜味,由于结构中都没有醛基,故都不能发生银镜反应;淀粉与纤维素都能水解生成葡萄糖,纤维素水解方程式:(C6H10O5)n+nH2 O→nC6H12O6;
故答案为:(C6H10O5)n;不;多;甜;不能;水解;葡萄糖;(C6H10O5)n+nH2 O→nC6H12O6.
点评 本题通过淀粉和纤维素来考查糖类的性质,难度不大,注意淀粉和纤维素虽然化学式相同但不是同分异构体.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:选择题
| A. | 稀硝酸与氢氧化钾溶液反应:H++OH-=H2O | |
| B. | 铝与稀盐酸反应:Al+2H+=Al3++H2↑ | |
| C. | 三氯化铁溶液与氢氧化钠溶液反应:FeCl3+3OH-=Fe(OH)3↓+3Cl- | |
| D. | 足量二氧化碳与澄清石灰水反应:CO2+2OH-=CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的颜色不再改变 | B. | 混合气体的密度不再改变 | ||
| C. | 混合气体的压强不再改变 | D. | 混合气体的平均分子质量不再改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间t(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
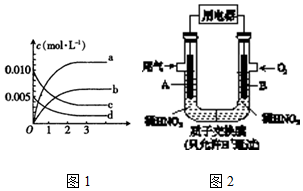
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
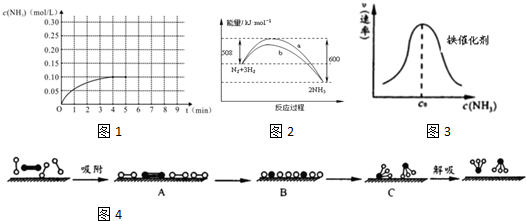
 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图4表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图4表示: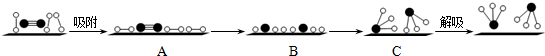
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g)(△H<0)
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g)(△H<0)查看答案和解析>>
科目:高中化学 来源: 题型:实验题
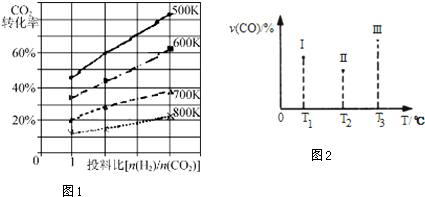
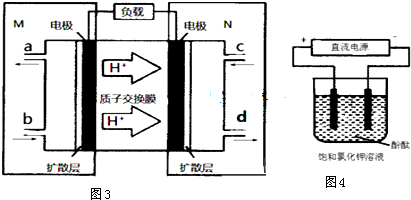
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | △H>0表示产物的总能量低于反应物的总能量 | |
| C. | △H 的单位kJ•mol-1,热量Q的单位为kJ | |
| D. | 化学键断裂过程中释放能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com