
【题目】下列有机反应中,不属于取代反应的是
A.![]() +Cl2
+Cl2![]()
![]() +HCl
+HCl
B.2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
C.ClCH2CH===CH2+ NaOH![]() HOCH2CH===CH2+NaCl
HOCH2CH===CH2+NaCl
D.![]() +HO—NO2
+HO—NO2![]()
![]() +H2O
+H2O
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】人体血液里Ca2+的浓度一般采用g/cm3来表示(即1cm3血样中含有的Ca2+的质量)。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得弱酸草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。
某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
(步骤1:配制KMnO4标准溶液)
如图是配制100mLKMnO4标准溶液的过程示意图。
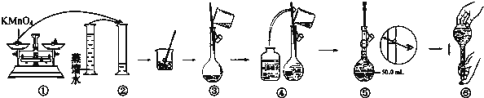
(1)请你观察图示判断,其中不正确的两项操作有___(填序号);
(2)其中确定100mL溶液体积的仪器是____。
(3)如果用图示的操作所配制的溶液进行实验,在其他操作正确的情况下,所配制的溶液浓度将___(填“偏大”或“偏小”)。
(步骤2:测定血液样品中Ca2+的浓度)
抽取血样20.00mL,经过上述处理后得到草酸,再用0.020mol/L酸性KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00mLKMnO4溶液。
(4)写出草酸与酸性KMnO4溶液反应的离子方程式____。
(5)滴定的终点为____。
(6)经过计算,血液样品中Ca2+的浓度为____g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分短周期元素的相关信息如下表所示:
元素代号 |
|
|
|
|
相关信息 | 海水中质量分数最高的元素 | 其简单氢化物的水溶液呈碱性 |
| 其简单离子是第3周期元素的简单离子中半径最小的 |
(1)![]() 在元素周期表中位于第______周期第______族;元素
在元素周期表中位于第______周期第______族;元素![]() 与元素
与元素![]() 相比,金属性较强的是______(用元素符号表示),下列能证明这一事实的是______(填序号)。
相比,金属性较强的是______(用元素符号表示),下列能证明这一事实的是______(填序号)。
a.![]() 单质的熔点比
单质的熔点比![]() 单质的低
单质的低
b.在化合物中![]() 的化合价比
的化合价比![]() 低
低
c.![]() 的单质能与冷水剧烈反应而
的单质能与冷水剧烈反应而![]() 的单质不能
的单质不能
d.![]() 、
、![]() 同周期且
同周期且![]() 在
在![]() 的右侧
的右侧
(2)![]() 与
与![]() 元素可形成含有共价键的常见二元离子化合物,该化合物的化学式为______,该化合物中离子键与共价键的数目比为______。
元素可形成含有共价键的常见二元离子化合物,该化合物的化学式为______,该化合物中离子键与共价键的数目比为______。
(3)![]() 、
、![]() 的氢化物
的氢化物![]() 、
、![]() 在一定条件下反应可得到一种单质和一种常温下为液体的物质,试写出该反应的化学方程式:__________________________________________。
在一定条件下反应可得到一种单质和一种常温下为液体的物质,试写出该反应的化学方程式:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用NaI溶液中通入少量Cl2得到含碘废液,再利用含碘废液获取NaI固体,实验流程如下:

已知反应②:2I﹣+2Cu2++![]() +H2O
+H2O![]() 2CuI↓+
2CuI↓+![]() +2H+。
+2H+。
回答下列问题:
(1)过滤实验所需要的玻璃仪器有普通漏斗、烧杯、_____________。
(2)反应③中CuI被氧化,还原产物只有NO2,该反应的化学方程式为_________________。当有95.5 g CuI参与反应,则需要标况下______________L的O2才能将生成的NO2在水中完全转化为硝酸。
(3)化合物B中含两种元素,铁原子与另一种元素原子的物质的量之比为3∶8,则化合物B的化学式为_____________。
(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则反应⑤的化学方程式为______。
(5)将足量的Cl2通入含12 g NaI的溶液中,一段时间后把溶液蒸干得到固体的质量为_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨和硝酸都是重要的工业原料。
(1)标准状况下,将500 L氨气溶于水形成1 L氨水,则此氨水的物质的量浓度为__mol· L-1(保留三位有效数字)。工业上常用过量氨水吸收二氧化硫,该反应的化学方程式为__。
(2)氨氧化法是工业生产中合成硝酸的主要途径。合成的第一步是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮,该反应的化学方程式为__。
下列反应中的氨与氨氧化法中的氨作用相同的是__。
A.2Na+2NH3===2NaNH2+H2↑ B.2NH3+3CuO===3Cu+N2+3H2O
C.4NH3+6NO===5N2+6H2O D.HNO3+NH3===NH4NO3
工业中的尾气(假设只有NO和NO2)用烧碱进行吸收,反应的离子方程式为2NO2+2OH﹣===NO2-+NO3-+H2O和NO+NO2+2OH﹣===□ +H2O(配平该方程式)。______________
(3)向27.2 g Cu和Cu2O的混合物中加入某浓度的稀HNO3500 mL,反应过程中产生的气体只有NO。固体完全溶解后,在所得溶液(金属阳离子只有Cu2+)中加入1 L 1 mol·L-1的NaOH溶液使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2 g。
①Cu与稀HNO3反应的离子方程式为__。
②Cu与Cu2O 的物质的量之比为__。
③HNO3的物质的量浓度为__mol·L-1。
(4)有H2SO4和HNO3的混合溶液20 mL,加入0.25 molL﹣1Ba(OH)2溶液时,生成沉淀的质量w(g)和Ba(OH)2溶液的体积V(mL)的关系如图所示(C 点混合液呈中性)。则原混合液中H2SO4的物质的量浓度为__mol·L-1,HNO3的物质的量浓度为__mol·L-1。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炭循环(如图)对人类生存、发展有着重要的意义,下列说法错误的是
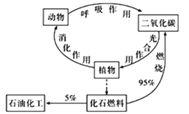
A.碳是组成有机物的主要元素
B.光合作用是将太阳能转化为化学能的过程
C.动物呼吸产生CO2的过程中,葡萄糖被氧化
D.碳元素在地壳中含量丰富,因此其形成的化合物数量众多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T ℃时,铬酸银(Ag2CrO4)在水溶液中的沉淀溶解平衡曲线如图所示,下列说法中不正确的是

A.向饱和Ag2CrO4溶液中加入固体K2CrO4能使溶液由Y点变为X点
B.T℃时,在Y点和Z点,Ag2CrO4的Ksp相等
C.T℃时,Ag2CrO4 的 Ksp数值为 1×10-11
D.图中a=![]() ×10-4
×10-4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光气是一种重要的有机中间体,在农药、医药、工程塑料、聚氨酯材料以及军事上都有许多用途。光气很容易水解,熔点为-118°C,沸点为8.2°C。某科研小组模拟工业生产由一氧化碳和氯气的混合物在活性炭作催化剂的条件下制取光气,其反应原理为:Cl2+CO=COCl2。装置如图所示(丙处的加油装置已省略,D中仪器用于收集光气)。
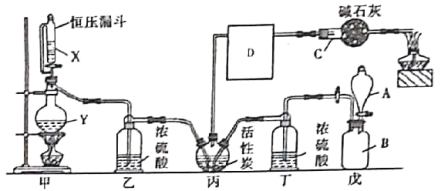
(1)仪器C的名称为___,其中碱石灰的作用为________________,D中仪器应浸在_____(填“冰水浴”或“热水浴”)中。
(2)仪器组装完成后,检验甲装置气密性的方法是_________。
(3)戊装置主要用于制取氯气,用酸性KMnO4和盐酸制取氯气时的离子方程式为__________。
(4)光气极易水解,遇水后易产生一种氢化物和一种氧化物,其反应的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯胺是一种长效缓释水消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2Cl,NHCl2和NCl3)。工业上可利用NH3(g)+Cl2(g) ![]() NH2Cl(g)+HCl(g)制备一氯胺。回答下列问题:
NH2Cl(g)+HCl(g)制备一氯胺。回答下列问题:
(1)氯胺作饮用水消毒剂是因为水解生成具有强烈杀菌作用的物质,该物质是___,二氯胺与水反应的化学方程式为___。
(2)已知部分化学键的键能和化学反应的能量变化如表和如图所示(忽略不同物质中同种化学键键能的细微差别)。
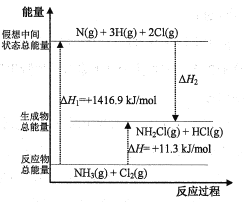
化学键 | N-H | N-Cl | H-Cl |
键能(kJ/mol) | 391.3 | x | 431.8 |
则ΔH2=___kJ/mol,x=___。
(3)在密闭容器中反应NH3(g)+Cl2(g) ![]() NH2Cl(g)+HCl(g)达到平衡,据此反应通过热力学定律计算理论上NH2Cl的体积分数随
NH2Cl(g)+HCl(g)达到平衡,据此反应通过热力学定律计算理论上NH2Cl的体积分数随![]() (氨氯比)的变化曲线如图所示。
(氨氯比)的变化曲线如图所示。
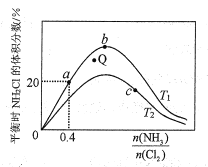
①a、b、c三点对应平衡常数的大小关系是___。T1温度下该反应的平衡常数为___(列出算式即可)。
②在T2温度下,Q点对应的速率:v正___v逆(填“大于”“小于”或“等于”)。
③在氨氯比一定时,提高NH3的转化率的方法是___(任写1种)
④若产物都是气体,实验测得NH2Cl的体积分数始终比理论值低,原因可能是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com