
分析 (1)3FeS2+8O2=Fe3O4+6SO2中Fe元素化合价又+2→+3,化合价升高,S元素化合价由-1→+4,化合价升高,O元素化合价由0→-2,化合价降低,反应消耗1mol氧气转移4mol电子;
(2)铁粉与水蒸气高温下反应生成四氧化三铁和氢气;
(3)设都制备1mol四氧化三铁,依据3FeS2+8O2 $\frac{\underline{\;高温\;}}{\;}$6SO2+Fe3O4,和3Fe+4H2O $\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
计算由FeS2反应得到SO2与消耗的水蒸气的物质的量之比;
(4)四氧化三铁与一氧化碳反应生成铁与二氧化碳.
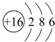
解答 解:(1)3FeS2+8O2=Fe3O4+6SO2中Fe元素化合价又+2→+3,化合价升高,S元素化合价由-1→+4,化合价升高,O元素化合价由0→-2,化合价降低,依据反应可知:1mol氧气参加反应转移4mol电子,则4mol O2参加反应转移电子的物质的量为16mol;
故答案为:16;
(2)铁粉与水蒸气高温下反应生成四氧化三铁和氢气,化学方程式:3Fe+4H2O $\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
故答案为:3Fe+4H2O $\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
(3)设都制备1mol四氧化三铁,依据3FeS2+8O2 $\frac{\underline{\;高温\;}}{\;}$6SO2+Fe3O4,可知生成6mol二氧化硫;
依据方程式:3Fe+4H2O $\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,可知生成1mol四氧化三铁,消耗水分子4mol;
所以当制得等质量的Fe3O4时,由FeS2反应得到SO2与消耗的水蒸气的物质的量之比是6:4=3:2;
故答案为:3:2;
(4)四氧化三铁与一氧化碳反应生成铁与二氧化碳,化学方程式:Fe3O4+4CO $\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2;
故答案为:Fe3O4+4CO $\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2;
点评 本题考查了化学方程式的书写,氧化还原反应转移电子数目的计算,明确物质的性质及发生的反应是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. |  热化学方程式是H2(g)+$\frac{1}{2}$O2(g)=H2O(g) DH=-241.8 kJ/mol | |
| B. | 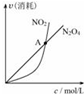 对于恒温恒容条件下的反应2NO2(g)?N2O4(g),A点为平衡状态 | |
| C. | 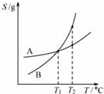 将A、B饱和溶液分别由T1℃升温至T2℃时,溶质的质量分数B>A | |
| D. |  HA的酸性强于HB |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/s | 0 | 500 | 100 0 | 150 0 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500s内N2O5分解速率为2.96×10-3mol•L-1•s-1 | |
| B. | T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为50% | |
| C. | 达平衡后其他条件不变,将容器的体积压缩到原来的1/2,则平衡时c(N2O5)>5.00mol•L-1 | |
| D. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 砒霜不是碱性氧化物 | B. | Na3As04是可熔性的正盐 | ||
| C. | 砒霜有剧毒,具有还原性 | D. | AsH3是氢化物,稳定性较强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 溶质 | NaHCO3 | Na2CO3 | NaF | NaClO |
| pH | 8.4 | .6 | 7.5 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(HF)<c(F-) | B. | c(Na+)<c(F-) | ||
| C. | c(F-)-c(HF)=c(H+)-c(OH-) | D. | c(HF)+c(F-)=0.1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | F | ||||
| 3 | Na | Al | Si | S | Cl | Ar |
 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com