【答案】
分析:A、加热条件下,铝与浓硫酸反应生成硫酸铝与二氧化硫、水,随反应进行浓硫酸变为稀硫酸,铝与稀硫酸反应生成硫酸铝与氢气,两反应都按n(Al):n(H
2SO
4)=2:3反应,据此根据Al与硫酸的物质的量判断.
B、3mol/L的硝酸是稀硝酸,铜与稀硝酸反应3Cu+8HNO
3═3Cu(NO
3)
2+2NO↑+4H
2O,根据方程式进行过量计算判断.
C、SO
2和O
2合成SO
3的反应是可逆反应,反应物不能完全转化.
D、二氧化锰越浓盐酸反应,随反应进行浓盐酸变成稀盐酸,二氧化锰与稀盐酸不反应.
解答:解:A、加热条件下,铝与浓硫酸反应生成硫酸铝与二氧化硫、水,随反应进行浓硫酸变为稀硫酸,铝与稀硫酸反应生成硫酸铝与氢气,两反应都按n(Al):n(H
2SO
4)=2:3=1:1.5反应,1g铝的物质的量为
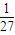
mol,20mL18.4mol/L浓硫酸中n(H
2SO
4)=0.02L×18.4mol/L=0.368mol,n(Al):n(H
2SO
4)=
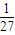
mol:0.368mol=1:9.94,所以硫酸过量,铝完全反应,故A正确;
B、3mol/L的硝酸是稀硝酸,铜与稀硝酸反应3Cu+8HNO
3═3Cu(NO
3)
2+2NO↑+4H
2O,100mL 3mol/L的硝酸中n(HNO
3)=0.1L×3mol/L=0.3mol,6.4gCu的物质的量我0.1mol,由方程式可知0.1molCu完全反应需要硝酸

×0.1mol=0.27,硝酸有剩余,故B错误;
C、SO
2和O
2合成SO
3的反应是可逆反应,二氧化硫不能完全转化,故C错误;
D、二氧化锰越浓盐酸反应,随反应进行浓盐酸变成稀盐酸,二氧化锰与稀盐酸不反应,盐酸不能完全反应,故D错误.
故选:A.
点评:考查根据方程式的计算、过量计算、可逆反应特点、物质浓度对反应的影响等,难度中等,注意物质浓度对性质性质的影响.

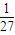 mol,20mL18.4mol/L浓硫酸中n(H2SO4)=0.02L×18.4mol/L=0.368mol,n(Al):n(H2SO4)=
mol,20mL18.4mol/L浓硫酸中n(H2SO4)=0.02L×18.4mol/L=0.368mol,n(Al):n(H2SO4)=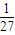 mol:0.368mol=1:9.94,所以硫酸过量,铝完全反应,故A正确;
mol:0.368mol=1:9.94,所以硫酸过量,铝完全反应,故A正确; ×0.1mol=0.27,硝酸有剩余,故B错误;
×0.1mol=0.27,硝酸有剩余,故B错误;
