

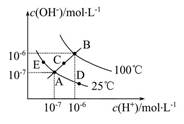
| A.a、c两点溶液的导电能力相同 |
| B.a、b、c三点溶液水的电离程度a>b>c |
C.b点溶液中 |
| D.用等浓度NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液体积Vb =Vc。 |


科目:高中化学 来源:不详 题型:单选题
| A.1/3Q1 kJ | B.1/3Q2 kJ | C.1/3(Q1+Q2) kJ | D.1/2Q2 kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.若a=b,则c(NH4+)=c(Cl-) |
| B.若a>b,则c(NH4+)>c(Cl-) |
| C.若a>b,则c(OH-)>c(H+) |
| D.若a<b,则c(OH-)<c(H+) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.I、Ⅱ分别表示盐酸和醋酸的滴定曲线 |
| B.盐酸和醋酸的浓度均为0.100 0 mol·L-1 |
| C.pH=7时,两种酸所消耗NaOH溶液的体积相等 |
| D.V(NaOH)=20.00mL时,c(Cl一)=c(CH3COO一) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.稀释pH=10的氨水,溶液中所有离子的浓度均降低 |
| B.pH均为5的HCl和NH4Cl溶液中,水的电离程度相同 |
| C.NaOH和CH3COONa的混合溶液中,c(Na+)+c(H+)=c(OH-)+c(CH3COO-) |
| D.分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.-44.2 kJ·mol-1 |
| B.+44.2 kJ·mol-1 |
| C.-2 777.8 kJ·mol-1 |
| D.+2 777.8 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1×10-7 | B.1/55.6 | C.10-14 | D.1/(55.6×107) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
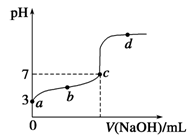
| A.a点表示溶液中c(CH3COO-)约为10-3 mol/L |
| B.b点表示的溶液中c(Na+)>c(CH3COO-) |
| C.c点表示CH3COOH和NaOH恰好反应完全 |
D.d点表示的溶液中 大于K 大于K |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com