
 可以由下列反应合成三聚氰胺:CaO+3C$\frac{\underline{\;高温\;}}{\;}$CaC2+CO↑,CaC2+N2$\frac{\underline{\;高温\;}}{\;}$CaCN2+C,CaCN2+2H2O═NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺.
可以由下列反应合成三聚氰胺:CaO+3C$\frac{\underline{\;高温\;}}{\;}$CaC2+CO↑,CaC2+N2$\frac{\underline{\;高温\;}}{\;}$CaCN2+C,CaCN2+2H2O═NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺.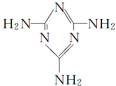 )俗称“蛋白精”,三聚氰酸(
)俗称“蛋白精”,三聚氰酸( 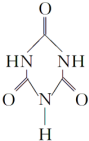 ).
).分析 (1)与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子是锌,根据构造原理写出该原子的核外电子排布式;等电子体原子总数相等,价电子总数相同,根据二氧化碳的空间构型确定CN22-离子的空间构型;
(2)根据价层电子对互斥理论确定尿素的VSEPR模型,根据模型确定其杂化方式和分子空间结构;
(3)①原子的得电子能力越强,其电负性的数值越大;同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,据此判断第一电离能大小顺序;
②氢键普遍存在于已经与N、O、F等电负性很大的原子形成共价键的氢原子与另外的N、O、F等电负性很大的原子之间;
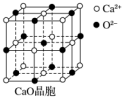
(4)以钙离子为中心,沿X、Y、Z三轴进行切割,从而确定钙离子配位数;以钙离子为中心,沿X、Y、Z三轴进行切割,从而确定钙离子配位数;密度等于质量除体积,摩尔质量除阿佛加德罗常数等于一个分子的质量,选择CaO晶胞中的小立方体模型列式求解钙离子间距;晶格能大小与离子带电量成正比,与离子半径成反比.
解答 解:(1)与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子是锌,根据构造原理,基态的锌原子核外电子排布式为1s22s22p63s23p63d104s2或[Ar]3d104s2;等电子体具有相同的价电子数、原子总数,结构相似,二氧化碳分子是直线形,所以CN22-离子的空间构型是直线形.
故答案为:1s22s22p63s23p63d104s2或[Ar]3d104s2;CO2;直线形;
(2)CO(NH2)2分子中中心原子C原子上含有三个σ键一个π键,所以空间构型是平面三角形,碳原子采取sp2杂化,故答案为:sp2;
(3)①元素原子的得电子能力越强,则电负性越大,所以O>N>C;
同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,C、N、O元素处于同一周期且原子序数逐渐增大,N处于第VA族,所以第一电离能N>O>C,故答案为:O>N>C>H;N>O>C;
②三聚氰酸与三聚氰胺分子相互之间能形成氢键,所以是通过分子间氢键结合,在肾脏内易形成结石.
故答案为:C;
(4)以钙离子为中心,沿X、Y、Z三轴进行切割,上下左右前后,结合图片知,钙离子的配位数是6,以钙离子为中心,沿X、Y、Z三轴进行切割,从上图可以看出,处于正方形对角线的两个离子的间距最小,所以晶胞中距离最近的两个钙离子之间的距离d=$\sqrt{2}$a=$\sqrt{2}$×$\root{3}{\frac{56}{2ρ×{N}_{A}}}$=$\sqrt{2}\root{3}{\frac{28}{ρ{N}_{A}}}$;晶格能大小与离子带电量成正比,CaO晶体中Ca2+、O2-的带电量大于NaCl晶体中Na+、Cl-的带电量,导致的氧化钙晶格能大于氯化钠的晶格能,
故答案为:6;$\sqrt{2}\root{3}{\frac{28}{ρ{N}_{A}}}$;CaO晶体中Ca2+、O2-的带电量大于NaCl晶体中Na+、Cl-的带电量.
点评 本题考查了物质结构知识,难度不大,易错点是配位数的确定,以一种微粒为中心,沿X、Y、Z三轴进行切割,从而确定配位数.


科目:高中化学 来源: 题型:选择题
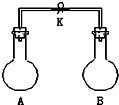 如图所示,室温下,A、B两个容积相等的烧瓶中分别集满了两种气体(同温、同压),当取下K夹,使两烧瓶内气体充分接触后,容器内压强由小到大的顺序正确的是( )
如图所示,室温下,A、B两个容积相等的烧瓶中分别集满了两种气体(同温、同压),当取下K夹,使两烧瓶内气体充分接触后,容器内压强由小到大的顺序正确的是( )| 编 号 | ① | ② | ③ | ④ |
| A中气体 | H2S | H2 | NH3 | NO |
| B中气体 | SO2 | Cl2 | HCl | O2 |
| A. | ②③④① | B. | ③①④② | C. | ③②①④ | D. | ④③②① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3和HCl;Na2CO3和HCl | B. | BaCl2 和H2SO4;Ba(OH)2和H2SO4 | ||
| C. | HCl 和Na2CO3;HCl和NaHCO3 | D. | KOH 和H2SO4;Ba(OH)2和HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu与浓硝酸反应制NO2:Cu+4HNO3(浓)═Cu2++2NO3-+2NO2↑+2H2O | |
| B. | 向Fe(NO3)2溶液中加入盐酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O | |
| C. | 碳酸氢钠溶液与少量石灰水反应:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| D. | 向Na2SiO3溶液中通入过量CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 500mL,0.2mol/L 的NaCl溶液 | B. | 1 000 mL,0.1mol/L 的MgCl2溶液 | ||
| C. | 50 mL,0.2mol/L 的CaCl2溶液 | D. | 100 mL,0.1mol/L 的AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
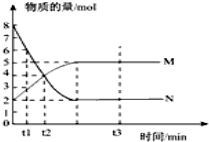 一定温度下,在容积为VL的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图示.
一定温度下,在容积为VL的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10gT2O含有的电子数为5NA | |
| B. | 常温下,0.2L 0.5mol•L-1NH4NO3溶液的氮原子数小于0.2NA | |
| C. | 用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.4NA | |
| D. | 常温常压下,5.6gC2H4和C3H6的混合气体中含氢原子数为0.9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com