
| ||
| ||
| ||
| ||


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
22、(5分)福岛核泄漏引发全球关注核安全。
(1)核电站提供了世界约17%的电能,核能的开发和利用,有效地缓解了化石燃料贮量不足带来的能源危机。化石燃料是指煤、 和天然气。
(2)福岛核电站爆炸的元凶是氢气,氢气燃烧爆炸时的化学方程式为 。核电站的氢气主要来源于燃料原件上的锆(Zr)高温下与水反应,生成氧化锆(ZrO2)和氢气,该反应的化学方程式为 。
(3)核电站利用核燃料铀—235发生核裂变产生的能量发电。放射性碘(![]() )是核裂变产物之一。
)是核裂变产物之一。![]() 原子核内有53个质子,78个中子,关于
原子核内有53个质子,78个中子,关于![]() ,下列说法正确的是__________(填序号)。
,下列说法正确的是__________(填序号)。
① ![]() 原子核外电子数为78 ②
原子核外电子数为78 ②![]() 的相对原子质量约为131
的相对原子质量约为131
③ 放射性碘和稳定性碘属于同种元素 ④ 碘是人体必需的微量元素
(4)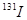 一旦被人体吸入会引发甲状腺疾病。服用含碘元素的物质可封闭甲状腺,让放射性碘无法“入侵”。我国规定在食盐中添加碘元素的标准为20-40mg/kg,若要达到防御
一旦被人体吸入会引发甲状腺疾病。服用含碘元素的物质可封闭甲状腺,让放射性碘无法“入侵”。我国规定在食盐中添加碘元素的标准为20-40mg/kg,若要达到防御![]() 辐射的作用,一次需补充碘元素100mg。按每人每天食用10g加碘盐,则我们每天最多能从碘盐中吸收 ______ mg碘元素。
辐射的作用,一次需补充碘元素100mg。按每人每天食用10g加碘盐,则我们每天最多能从碘盐中吸收 ______ mg碘元素。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年黑龙江大庆市高三毕业班联考化学试卷 题型:填空题
22、(5分)福岛核泄漏引发全球关注核安全。
(1)核电站提供了世界约17%的电能,核能的开发和利用,有效地缓解了化石燃料贮量不足带来的能源危机。化石燃料是指煤、 和天然气。
(2)福岛核电站爆炸的元凶是氢气,氢气燃烧爆炸时的化学方程式为 。核电站的氢气主要来源于燃料原件上的锆(Zr)高温下与水反应,生成氧化锆(ZrO2)和氢气,该反应的化学方程式为 。
(3)核电站利用核燃料铀—235发生核裂变产生的能量发电。放射性碘(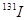 )是核裂变产物之一。
)是核裂变产物之一。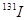 原子核内有53个质子,78个中子,关于
原子核内有53个质子,78个中子,关于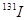 ,下列说法正确的是__________(填序号)。
,下列说法正确的是__________(填序号)。
① 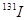 原子核外电子数为78
②
原子核外电子数为78
②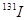 的相对原子质量约为131
的相对原子质量约为131
③ 放射性碘和稳定性碘属于同种元素 ④ 碘是人体必需的微量元素
(4)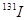 一旦被人体吸入会引发甲状腺疾病。服用含碘元素的物质可封闭甲状腺,让放射性碘无法“入侵”。我国规定在食盐中添加碘元素的标准为20-40mg/kg,若要达到防御
一旦被人体吸入会引发甲状腺疾病。服用含碘元素的物质可封闭甲状腺,让放射性碘无法“入侵”。我国规定在食盐中添加碘元素的标准为20-40mg/kg,若要达到防御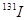 辐射的作用,一次需补充碘元素100mg。按每人每天食用10g加碘盐,则我们每天最多能从碘盐中吸收 ______ mg碘元素。
辐射的作用,一次需补充碘元素100mg。按每人每天食用10g加碘盐,则我们每天最多能从碘盐中吸收 ______ mg碘元素。
查看答案和解析>>
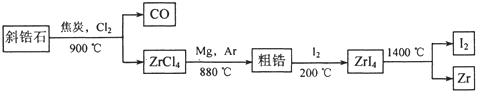
科目:高中化学 来源:四川省模拟题 题型:填空题

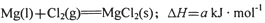
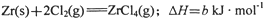
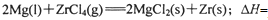 ______________ 该反应在Ar气氛中进行的理由是______________。
______________ 该反应在Ar气氛中进行的理由是______________。 查看答案和解析>>
科目:高中化学 来源:2012届黑龙江大庆市三十二中高三毕业班联考化学试卷 题型:填空题
22、(5分)福岛核泄漏引发全球关注核安全。
(1)核电站提供了世界约17%的电能,核能的开发和利用,有效地缓解了化石燃料贮量不足带来的能源危机。化石燃料是指煤、 和 天然气。
天然气。
(2)福岛核电站爆炸的元凶是氢气,氢气燃烧爆炸时的化学方程式为 。核电站的氢气主要来源于燃料原件上的锆(Zr)高温下与水反应,生成氧化锆(ZrO2)和氢气,该反应的化学方程式为 。
(3)核电站利用核燃料铀—235发生核裂变产生的能量发电。放射性碘(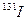 )是核裂变产物之一。
)是核裂变产物之一。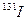 原子核内有53个质子,78个中子,关于
原子核内有53个质子,78个中子,关于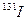 ,下列说法正确的是__________(填序号)。
,下列说法正确的是__________(填序号)。
①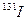 原子核外电子数为78 ②
原子核外电子数为78 ②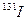 的相对原子质量约为131
的相对原子质量约为131
③ 放射性碘和稳定性碘属于同种元素 ④ 碘是人体必需的微量元素
(4)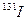 一旦被人体吸入会引发甲状腺疾病。服用含碘元素的物质可封闭甲状腺,让放射性碘无法“入侵”。我国规
一旦被人体吸入会引发甲状腺疾病。服用含碘元素的物质可封闭甲状腺,让放射性碘无法“入侵”。我国规 定在食盐中添加碘元素的标准为20-40mg/kg,若要达到防御
定在食盐中添加碘元素的标准为20-40mg/kg,若要达到防御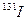 辐射的作用,一次需补充碘元素100mg。按每人每天食用10g加碘盐,则我们每天最多能从碘盐中吸收 ______ mg碘元素。
辐射的作用,一次需补充碘元素100mg。按每人每天食用10g加碘盐,则我们每天最多能从碘盐中吸收 ______ mg碘元素。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com