
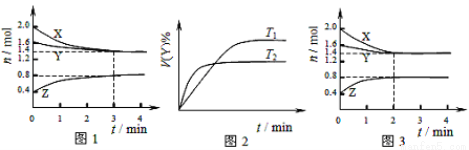
T ��ʱ��2L�ݻ�������ܱ�������ʹX(g)��Y(g)������Ӧ����Z(g)����Ӧ������X��Y��Z ��Ũ�ȱ仯��ͼ1��ʾ�������������������䣬�¶ȷֱ�ΪT1��T2ʱ��Y������ٷֺ�����ʱ��Ĺ�ϵ��ͼ2��ʾ�������н��۴�����ǣ� ��
A�������з����ķ�Ӧ�ɱ�ʾΪ��3X(g)+Y(g)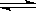 2Z(g)
2Z(g)
B��ͼ1 ��Ӧ����ǰ3min�ڣ���X��ʾ�ķ�Ӧ����v(X)��0.1mol/(L��min)
C�����ı䷴Ӧ������ʹ��Ӧ������ͼ3��ʾ����ı��������ʹ�ô���
D�����������������䣬�����¶ȣ���ѧƽ�����淴Ӧ�����ƶ�
D
��������
���������A. ����ͼ1��֪����ͬ��ʱ����X��С0.6��Y����0.2��Z����0.4�����ո������ʵ�Ũ�ȶ����ٷ����仯�����Ը÷�Ӧ�ǿ��淴Ӧ�������з����ķ�Ӧ�ɱ�ʾΪ��3X(g)+Y(g) 
 2Z(g)����ȷ��B��ͼ1 ��Ӧ����ǰ3min�ڣ���X��ʾ�ķ�Ӧ����v(X)��(0.6mol��2L)��3min=0.1mol/(L��min)����ȷ��C.���ڸı䷴Ӧ������Ӧ���ʼӿ죬�����˴ﵽƽ������Ҫ��ʱ�䣬�������ʵ�ƽ�⺬�����䣬��ı��������ʹ�ô�������ȷ��D������ͼ2��֪���¶�ΪT2ʱ���ȴﵽ�жϣ������������¶ȣ���ѧ��Ӧ���ʼӿ죬����T2>T1�����������¶Ⱥ�Y��ƽ�⺬�����ͣ�˵�������¶ȣ�ƽ��������Ӧ�����ƶ�������ƽ���ƶ�ԭ���������¶ȣ�ƽ�������ȷ�Ӧ�����ƶ�������ӦΪ���ȷ�Ӧ������
2Z(g)����ȷ��B��ͼ1 ��Ӧ����ǰ3min�ڣ���X��ʾ�ķ�Ӧ����v(X)��(0.6mol��2L)��3min=0.1mol/(L��min)����ȷ��C.���ڸı䷴Ӧ������Ӧ���ʼӿ죬�����˴ﵽƽ������Ҫ��ʱ�䣬�������ʵ�ƽ�⺬�����䣬��ı��������ʹ�ô�������ȷ��D������ͼ2��֪���¶�ΪT2ʱ���ȴﵽ�жϣ������������¶ȣ���ѧ��Ӧ���ʼӿ죬����T2>T1�����������¶Ⱥ�Y��ƽ�⺬�����ͣ�˵�������¶ȣ�ƽ��������Ӧ�����ƶ�������ƽ���ƶ�ԭ���������¶ȣ�ƽ�������ȷ�Ӧ�����ƶ�������ӦΪ���ȷ�Ӧ������
���㣺���黯ѧ����ʽ��ȷ�����¶ȡ������Ի�ѧƽ���ƶ���Ӱ���֪ʶ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014��2015ѧ�꽭�����ݸ�����ѧ��У���߶�9���¿�B�㻯ѧ�Ծ��������棩 ���ͣ�ʵ����
��10�֣�ijʵ��С����0��50 mol��L-1NaOH��Һ��0��50 mol��L-1������Һ�����к��ȵIJⶨ��
������0��50 mol��L-1NaOH��Һ
��1����ʵ���д�ԼҪʹ��470 mL NaOH��Һ,������Ҫ����NaOH���� g��
��2����ͼ��ѡ�����NaOH��������Ҫ��������(����ĸ): ��
���� | ������ƽ | С�ձ� | ����ǯ | ������ | ҩ�� | ��Ͳ |
���� |
|
|
|
|
|
|
��� | a | b | c | d | e | f |
�ⶨ�к��ȣ���1��ʵ�����ϱ����ձ�(��С�����ձ�)����ĭ���ϡ���ĭ���ϰ塢��ͷ�ιܡ���Ͳ�����ᡢNaOH��Һ,��ȱ�ٵ�ʵ�鲣����Ʒ�� ��
��2��ȡ50 mL NaOH��Һ��30 mL������Һ����ʵ��,ʵ���������±���������д�±��еĿհ�:
ʵ�� ���� | ��ʼ�¶�t1/�� | ��ֹ�¶� t2/�� | �¶Ȳ�ƽ��ֵ (t2-t1)/�� | ||
H2SO4 | NaOH | ƽ��ֵ | |||
1 | 26��2 | 26��0 | 26��1 | 30��1 |
|
2 | 27��0 | 27��4 | 27��2 | 33��3 | |
3 | 25��9 | 25��9 | 25��9 | 29��8 | |
4 | 26��4 | 26��2 | 26��3 | 30��4 | |
�ڽ�����Ϊ0��50 mol��L-1NaOH��Һ��0��50 mol/L������Һ���ܶȶ���1 g/cm3,�кͺ�������Һ�ı�����c=��4��18��J/(g����)�����к��Ȧ�H= (ȡС�����һλ)��
������ʵ����ֵ�����57��3 kJ��mol-1��ƫ��,����ƫ���ԭ�������(����ĸ) ��
A��ʵ��װ�ñ��¡�����Ч���� B����ȡNaOH��Һ�����ʱ���Ӷ���
C���ֶ�ΰ�NaOH��Һ����ʢ�������С�ձ���
D�����¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�ֱ�ӲⶨH2SO4��Һ���¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014��2015ѧ�꽭�����ݸ�����ѧ��У���߶�9���¿�A�㻯ѧ�Ծ��������棩 ���ͣ�ѡ����
�������й����ر���жϲ���ȷ���ǣ�������
A���ܽ�����ʳ����ˮ�У�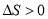 B����̼��������Ӧ����
B����̼��������Ӧ����
C��H2O(g)���Һ̬ˮ�� D��CaCO3(s)���ȷֽ�ΪCaO��CO2(g)��
D��CaCO3(s)���ȷֽ�ΪCaO��CO2(g)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014��2015ѧ�꽭�����ݸ�����ѧ��У����һ9���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�ÿ����Ա��μ���SO42-���ӵĴ���ʱ�����ڴ�����Һ�м������ᣬ�������� ( )
A���γɽ϶�İ�ɫ���� B���ų�SO42-��������������Ӽ�Ag+�ĸ���
C���γɵij������ȸ��� D���ų�Ba2+��������������ӵĸ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014��2015ѧ�꽭����У9�������߶���ѧ�Ծ��������棩 ���ͣ������
��10�֣� ����̼ѭ������������ĸ߶����ӣ���֪ú������ȿ�����ˮ������Ӧ������CO��H2Ϊ���ĺϳ������ϳ����й㷺Ӧ�á��Իش��������⣺
��1����¯������CO�������Ҫ��;֮һ���������ӦΪ��FeO(s)��CO(g) Fe(s)��CO2(g) ��H��0����֪��1 100 ��ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��K=0.263��
Fe(s)��CO2(g) ��H��0����֪��1 100 ��ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��K=0.263��
���¶����ߣ���ѧƽ���ƶ���ﵽ�µ�ƽ�⣬��ʱƽ�ⳣ��Kֵ (���������С�����䡱)��
��1 100 ��ʱ��ø�¯�У�c(CO2)=0.025 mol��L-1��c(CO)=0.1 mol��L-1��������������£��÷�Ӧ�� ����(����ҡ�)���ж������� ��
��2��Ŀǰ��ҵ��Ҳ����CO2������ȼ�ϼ״����йط�ӦΪ��
CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ��H=��49.0KJ/mol���������Ϊ1L���ܱ������г���1mol CO2��3molH2����Ӧ�����в��CO2��CH3OH��g����Ũ����ʱ��ı仯��ͼ��ʾ��
CH3OH(g)+H2O(g) ��H=��49.0KJ/mol���������Ϊ1L���ܱ������г���1mol CO2��3molH2����Ӧ�����в��CO2��CH3OH��g����Ũ����ʱ��ı仯��ͼ��ʾ��
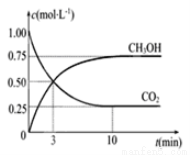
�ٴӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����V��H2��=------------��
�ڷ�Ӧ�ﵽƽ������д�ʩ��ʹ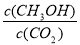 �������-------������ţ�
�������-------������ţ�
A�������¶� B���ٳ���H2 C���ٳ���CO2 D����H2O��g������ϵ�з��� E������He��g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014��2015ѧ�꽭����У9�������߶���ѧ�Ծ��������棩 ���ͣ�ѡ����
ǿ���ǿ���ϡ��Һ���к��ȿɱ�ʾΪ��H+(aq)+OH-(aq)=H2O(l) ��H=��57.3KJ/mol
��֪CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ��H=��Q1KJ/mol
1/2H2SO4(Ũ)+NaOH(aq)=1/2Na2SO4(aq)+H2O(l) ��H=��Q2KJ/mol
HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(l) ��H=��Q3KJ/mol
������Ӧ��Ϊ��Һ�еķ�Ӧ����Q1��Q2��Q3�ľ���ֵ��С�Ĺ�ϵΪ�� ��
A��Q1=Q2=Q3 B��Q2>Q1>Q3 C��Q2>Q3>Q1 D��Q2=Q3>Q1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014��2015ѧ�꽭����У9�������߶���ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵������ȷ����(����)
A����H<0����S>0�ķ�Ӧ���κ��¶��¶����Է�����
B��NH4HCO3(s) NH3 (g)+H2O(g)+CO2(g)����H=+185.57 kJ��mol-1���Է�����,ԭ������ϵ���Է�������Ҷ����ӵķ���ת�������
NH3 (g)+H2O(g)+CO2(g)����H=+185.57 kJ��mol-1���Է�����,ԭ������ϵ���Է�������Ҷ����ӵķ���ת�������
C����Ϊ�ʱ���ر䶼�뷴Ӧ���Է����й�,����ʱ���ر�����Ե�����Ϊ��Ӧ�Է��Ե��о�
D�������������������������,ʹ�ô���,���Ըı仯ѧ��Ӧ���е�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�����ʡ�����и߶���ѧ�����л�ѧ���ģ��Ծ��������棩 ���ͣ�ѡ����
����������绯ѧ��ʴ�ص���
A����ͭ��ͭп�Ͻ�������ͭ��ײ���ͭ��
B�������������ģ������Ǵ�������������
C��������������ͭ��������ڽӴ���������
D�����ʽ����ڿ����о��ú����䰵
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�︣��ʡ�߶���ѧ�����л�ѧ���ģ��Ծ��������棩 ���ͣ�ѡ����
����ʵ�������ȷ����
A������Ͳ��ȡ5.0 mLŨ���Ტֱ������Ͳ��ϡ��
B�����촵��ȼ�ŵľƾ��ƻ���
C������NaOH����ʱ����ҩƷֱ�ӷ���������
D������ƿ���Һ�����ʱ������ʯ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com