
| | | | | | X |
| Y | | Z | W | | R |
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源:不详 题型:填空题
| A.同一主族的元素从上到下金属性逐渐减弱 |
| B.元素周期表是元素周期律的具体表现形式 |
| C.同一周期从左到右,元素原子半径逐渐增大 |
| D.非金属元素的最高正化合价等于它的负化合价的绝对值 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
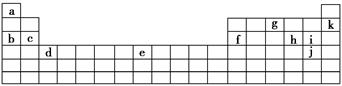
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.冰融化时,分子中H—O键发生断裂 |
| B.随着电子层数的增加,卤化物CX4分子间作用力逐渐增大,所以它们相应的熔沸点也逐渐升高 |
| C.由于H—O键比H—S键牢固,所以水的熔沸点比H2S高 |
| D.在由分子所构成的物质中,分子间作用力越大,该物质越稳定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
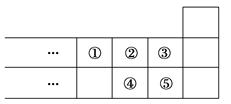
| A.元素①位于第二周期第ⅣA族 |
| B.气态氢化物的稳定性:④>② |
| C.最高价氧化物对应水化物的酸性:⑤>④ |
| D.元素的最高正化合价:③=⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 周期 | ⅠA | | 0 | |||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | | | ⑦ | ⑧ | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 。
。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 周期数 | 一 | 二 | 三 | 四 | 五 | 六 | 七 |
| 元素种类 | 2 | 8 | 8 | 18 | 18 | 32 | 32 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com