
| 化学键 | H-H | H-Cl | C-Si | Si-Si | Si-Cl |
| 键能(kJ/mol) | 436 | 431 | 347 | 176 | 360 |
 ;
; ;
;

 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案科目:高中化学 来源: 题型:
| A、生铁、不锈钢和黄金都属于合金 |
| B、水泥、玻璃、陶瓷均属于无机非金属材料 |
| C、淀粉、油脂、蛋白质都属于天然高分子化合物 |
| D、天然气、石油液化气和汽油的主要成分都属于烃类 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将化学能转化为电能电池 |
| B、放电时,H+向正极移动 |
| C、正极反应式为:O2+2H2O+4e-═4OH- |
| D、负极反应式可能为:S2-+4H2O-8e-═SO42-+8H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
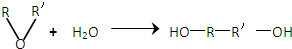
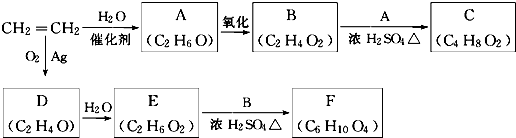
查看答案和解析>>
科目:高中化学 来源: 题型:
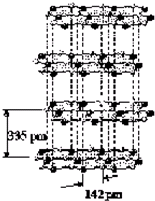 太阳能电池的发展已经进入了第三代.第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜铟镓硒CIGs(CIS中掺入Ga)等化合物薄膜太阳能电池以及薄膜Si系太阳能电池.
太阳能电池的发展已经进入了第三代.第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜铟镓硒CIGs(CIS中掺入Ga)等化合物薄膜太阳能电池以及薄膜Si系太阳能电池.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、上述四种元素的原子半径大小为Y<X<W |
| B、W、X、Y原子的核外最外层电子数的总和为10 |
| C、由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 |
| D、W与Y可形成既含极性共价键又含非极性共价键的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在NA个NO2分子与水的反应中,转移电子数为2NA |
| B、0.1NA个Cu与含0.2mol溶质的浓硫酸共热,被还原的硫酸为0.1mol |
| C、19.2gCu与足量稀硝酸反应,生成0.2NA个NO分子 |
| D、标准状况下11.2LNH3溶解于1000 mL水中,所得溶液的物质的量浓度为0.5 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲>乙>丙 |
| B、甲=乙=丙 |
| C、乙>甲>丙 |
| D、甲>丙>乙 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com