
| A、对于反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0,若使用催化剂,反应过程中放出的热量更多 |
| B、已知2C(s)+2O2(g)=2CO2(g)△H1,2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2 |
| C、在一定条件下,某可逆反应的△H=+72.5kJ/mol,则该反应正反应活化能比逆反应活化能大72.5kJ/mol |
D、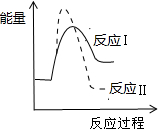 已知某物质在一定条件下可发生两个化学反应,反应过程中的总能量变化如图所示,由图示可知,反应Ⅰ是吸热反应,反应Ⅱ是放热反应,且反应Ⅰ的速率(v1)小于反应Ⅱ的速率(v2) |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、1mol CH3OH(g)完全燃烧放出的热量大于192.9 kJ | ||
B、根据反应①和②推知反应:H2(g)+
| ||
| C、CH3OH转变成H2的过程不一定要吸收能量 | ||
D、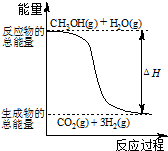 反应①中的能量变化如图所示 |
查看答案和解析>>
科目:高中化学 来源: 题型:
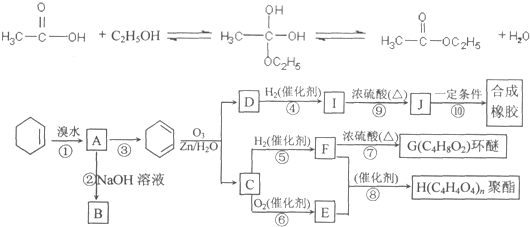
| O3,Zn/H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
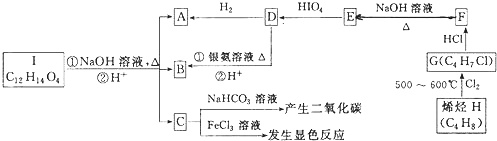
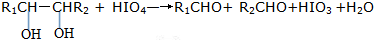
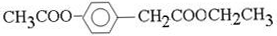
| 500~600℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(s) n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、胶体粒子直径在lnm~100nm |
| B、遇BaCl2溶液或Fe(OH)3胶体可发生聚沉 |
| C、电泳时,该胶体向阴极方向移动 |
| D、Na+使此胶体凝聚的效果不如Ca2+、Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
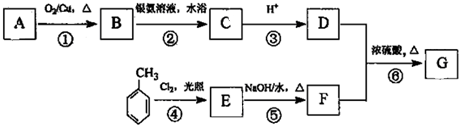
查看答案和解析>>
科目:高中化学 来源: 题型:
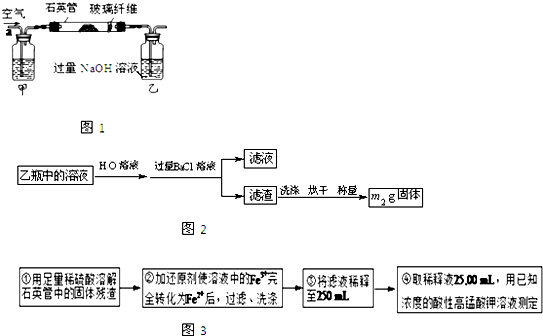
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com