
如图,在盛有稀 H2SO4 的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
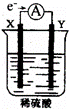
A. 外电路的电流方向为:X→外电路→Y
B. 若两电极分别为Fe和碳棒,则X为碳棒,Y为Fe
C. X极上发生的是还原反应,Y极上发生的是氧化反应
D. 若两电极都是金属,则它们的活动性顺序为X>Y
科目:高中化学 来源:2016-2017学年湖北省高一12月月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.Fe在一定条件下与水反应生成H2和Fe(OH)3
B.Fe3O4溶于盐酸后加入几滴KSCN溶液,溶液显红色
C.足量的铁粉与氯气反应可制得FeCl2
D.FeCl3饱和溶液滴入NaOH溶液中可制备Fe(OH)3胶体
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高一上期中化学试卷(解析版) 题型:选择题
下列离子检验的方法正确的是( )
A.某溶液 有白色沉淀,说明原溶液中有Cl-
有白色沉淀,说明原溶液中有Cl-
B.某溶液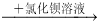 有白色沉淀,说明原溶液中有SO42-
有白色沉淀,说明原溶液中有SO42-
C.某溶液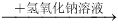 有蓝色沉淀,说明原溶液中有Cu2+
有蓝色沉淀,说明原溶液中有Cu2+
D.某溶液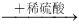 生成无色气体,说明原溶液中有CO32-
生成无色气体,说明原溶液中有CO32-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年西藏拉萨中学高二上期末化学试卷(解析版) 题型:选择题
常温下,有下列四种溶液:
① | ② | ③ | ④ |
0.1 mol/L NaOH溶液 | pH = 11 NaOH溶液 | 0.1 mol/L CH3COOH溶液 | pH = 3 CH3COOH溶液 |
下列说法正确的是:
A.由水电离出H+的浓度c(H+):①>③
B.将④加蒸馏水稀释至原来的100倍时,所得溶液的pH=5
C.①与③混合,若溶液pH=7,则体积:V(NaOH)>V(CH3COOH)
D.将②与④等体积混合,若溶液pH<7,各离子浓 度的关系为:c(CH3COO-)+c(OH-)=c(Na+)+c(H+)
度的关系为:c(CH3COO-)+c(OH-)=c(Na+)+c(H+)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年西藏拉萨北京实验中学高二上期末化学卷(解析版) 题型:填空题
铁、铝及其化合物在生产和生活中有着广泛的应用.
(1)某研究性学习小组设计了如图所示装置探究钢铁的腐蚀与防护.
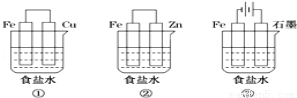
在相同条件下,三组装置中铁电极腐蚀最快的是 (填装置序号),该装置中正极电极反应式为 ;为防止金属Fe被腐蚀,可以采用上述 (填装置序号)装置原理进行防护;装置③中总反应的离子方程式为 。
( 2)新型固体LiFePO4隔膜电池广泛应用于电动汽车。电池反应为FePO4 + Li
2)新型固体LiFePO4隔膜电池广泛应用于电动汽车。电池反应为FePO4 + Li LiFePO4,电解质为含Li+的导电固体,且充、放电时电池内两极间的隔膜只允许Li+自由通过而导电。该电池放电时Li+向______极移动(填“正”或“负”),负极反应为Li-e— =Li+,则正极反应式为____________。
LiFePO4,电解质为含Li+的导电固体,且充、放电时电池内两极间的隔膜只允许Li+自由通过而导电。该电池放电时Li+向______极移动(填“正”或“负”),负极反应为Li-e— =Li+,则正极反应式为____________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年西藏拉萨北京实验中学高二上期末化学卷(解析版) 题型:选择题
锅炉水垢是一种安全隐患,除去水垢中的CaSO4,可先 用Na2CO3溶液处理,使之转化为易溶于酸的CaCO3,再用酸除去.下列说法不正确的是( )
用Na2CO3溶液处理,使之转化为易溶于酸的CaCO3,再用酸除去.下列说法不正确的是( )
A.CaCO3的溶解度小于CaSO4
B.沉淀转化的实质是沉淀溶解平衡的移动
C.沉淀转化的难易与溶解度差别的大小无关
D.CaSO4到CaCO3的沉淀转化中并存着两个沉淀溶解平 衡
衡
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高二12月月考化学卷(解析版) 题型:选择题
已知反应:①101kPa时,2C(石墨)+ O2(g)= 2CO(g) ΔH= -221 kJ/mol
②稀溶液中,H +(aq)+ OH-(aq)= H2O(1) ΔH= -57.3 kJ/mol
下列结论正确的是
A.C(石墨)的燃烧热大于 110.5 kJ/mol
B.稀硫酸与稀 NaOH溶液反应的反应热为-57.3 kJ/mol
C.若已知CO的燃烧热为283kJ/mol,则C(金刚石)的燃烧热为393.5 kJ/mol
D.稀醋酸与稀 NaOH溶液反应,每生成 1mol液态水就会放出 57.3 kJ热量
查看答案和解析>>
科目:高中化学 来源:2016-2017年陕西西藏民族学院附中高二12月月考化学卷(解析版) 题型:选择题
下列叙述中,不能用勒夏特列原理解释的是
A.红棕色的NO2,加压后颜色先变深后变浅
B.高压比常压有利于合成SO3的反应
C.由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深
D.黄绿色的氯水光照后颜色变浅
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高二上月考四化学卷(解析版) 题型:填空题
(1)已知常温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,则该溶液的pH= ,此酸的电离平衡常数K= ,由HA电离出的H+的浓度约为水电离出的H+的浓度的 倍。
(2)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶剂。向其中加入少量酸或碱时,溶液的酸碱性变化不大。
①向该溶液中加入少量盐酸时,发生反应的离子方程式是 ,向其中加入少量KOH溶液时,发生反应的离子方程式是 。
②现将0.04mol﹒L-1HA溶液和0.02mol﹒L-1NaOH溶液等体积混合,得到缓冲溶液。
a、若HA为HCN,该溶液显碱性,则溶液中c(Na+) c(CN-)(填“<”、“=”或“>”)。
b、若HA为CH3COOH,该溶液显酸性,溶液中所有的离子按浓度由大到小排列的顺序是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com