
[化学——物质结构与性质](13分)
物质结构理论有助于人们研究化学反应规律。请回答下列问题:
(1)在第三周期中,第一电离能大于硫的元素有 种;
(2)铜及其化合物在科学研究和工农业生产中有许多用途。
①铜原子价电子排布式为
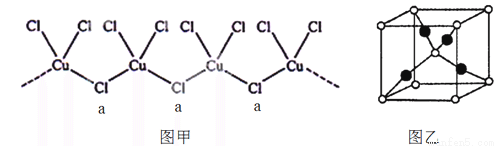
②氯、钾、铜(+1价)三元素可形成一种化合物,该化合物阴离子为无限长链结构(如图甲),a位置上Cl原子的杂化轨道类型为 。该化合物阴离子的化学式为 ;
③向CuSO4溶液中加入过量氨水,可生成[Cu(NH3)4]SO4,下列说法正确的是 。
A.氨气极易溶液水,是因为NH3分子和H2O分子之间形成3种不同的氢键
B.NH3分子的键角小于H2O分子的键角
C.[Cu(NH3)4]SO4所含的化学键有离子键、极性共价键和配位键
D.[Cu(NH3)4]SO4组成元素中电负性最大的是氮元素
④葡萄糖与新制氢氧化铜的碱性溶液反应生成砖红色沉淀A,其晶胞如右图乙所示。A的化学式为 ,晶胞中的白点代表的原子是 (填元素名称)。
(1)3(2分)
(2)①3d104s1 (2分)②sp3 (2分) [CuCl3]2- (2分)③C (2分)④Cu2O(2分) 氧(1分)
【解析】
试题分析:(1)一般情况下同一周期的元素,原子序数越大,第一电离能就越大,但是由于P元素的原子最外层电子处于半充满的稳定状态,素第一电离能比S大,因此在第三周期中,第一电离能大于硫的元素有P、Cl、Ar三种元素;(2)①铜是29号元素,由于原子核外电子处于全充满、半充满或全空时是稳定的状态,所以其原子价电子排布式3d104s1;②氯、钾、铜(+1价)三元素可形成一种化合物,该化合物阴离子为无限长链结构,在a位置上Cl原子的杂化轨道类型为sp3。由于Cu的化合价是+1价,与每一个Cu原子结合的Cl原子的个数是2+2×1/2=3,Cl的化合价是-1价,所以该化合物阴离子的化学式为[CuCl3]2-;③向CuSO4溶液中加入过量氨水,可生成[Cu(NH3)4]SO4是由于Cu2+容易与NH3形成配位键;A.氨气极易溶液水,是因为NH3分子和H2O分子都是极性分子,根据相似相溶原理可知:由极性分子构成的溶质容易溶解在由极性分子构成的溶剂中,错误;B.NH3分子的键角是107°18′,而H2O分子的键角是104.3°,因此键角前者大于后者;错误;C.[Cu(NH3)4]SO4所含的化学键有[Cu(NH3)4]2+、SO42-之间的离子键、N—H极性键及SO42-内的S=O极性共价键和[Cu(NH3)4]2+内的Cu2+与NH3之间的配位键,正确;D.[Cu(NH3)4]SO4组成元素中电负性最大的是氧元素,错误;④葡萄糖与新制氢氧化铜的碱性溶液反应生成砖红色沉淀A氧化亚铜,其晶胞如右图乙所示。黑球:4×1=4,白球:8×1/8+1=2;所以二者的个数比是:4:2=2:1,所以A的化学式为Cu2O,晶胞中的白点代表的原子是O。
考点:考查元素的电离能与电负性的比较、原子的价电子排布式、络合物的结构与性质、晶体结构与化学式的确定的知识。


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源:2015届贵州省贵阳市高三年级8月摸底考试化学试卷(解析版) 题型:选择题
贵州凤岗的“富锌富硒”茶已享誉全国,因富含硒元素,有延年益寿、抗衰老等作用。但研究表明单质硒可能成为环境污染物,通过与浓盐酸、浓H2SO4反应可回收Se。在回收过程中涉及到如下两个化学反应:①SeO2+4KI+4HCl=Se+2I2+4KCl+2H2O;②Se+2H2SO4(浓)=2SO2 + SeO2+2H2O。下列叙述正确的是( )
+ SeO2+2H2O。下列叙述正确的是( )
A.反应①中Se是氧化产物,I2是还原产物
B.反应②中浓H2SO4是氧化剂,SeO2是还原产物
C.反应①中每有1.0mol I2生成,转移电子数目为4 NA
D.SeO2、H2SO4(浓)、I2的氧化性由强到弱的顺序是H2SO4(浓)> SeO2> I2
查看答案和解析>>
科目:高中化学 来源:2015届福建省高二上学期第二次月考化学试卷(解析版) 题型:选择题
下列有关说法正确的是 ( )
A.活化分子的总数越多,反应速率越快
B.升高温度,活化分子百分数不变,活化分子数增多,化学反应速率增大
C.使用催化剂,降低了反应的活化能,增大了活化分子百分数,化学反应速率增大
D.加入反应物,使活化分子百分数增大,化学反应速率增大
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中考试化学试卷(解析版) 题型:选择题
如图示的装置中,把X溶液逐滴滴下与Y物质反应,若X为浓硫酸,Y为第三周期金属元素中常温下与水难反应的单质。Z为品红溶液。实验中观察到Z褪色。则Y为
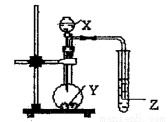
A.Na B.Mg C.Al D.Mg或Al
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中考试化学试卷(解析版) 题型:选择题
下列叙述符合实验事实的是
A.金属钠与水反应放出氧气
B.金属钠在空气中燃烧生成氧化钠
C.金属钠在空气中燃烧生成白色的Na2O2
D.金属钠在水中可以生成使酚酞变红的物质
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期第二次质量检查化学试卷(解析版) 题型:选择题
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。
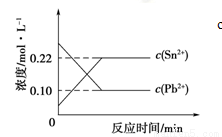
下列判断正确的是
A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后, c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应⊿H>0
D.25℃时,该反应的平衡常数K=2.2
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中考试化学试卷(解析版) 题型:实验题
(16分)某学校化学学习小组为探究二氧化氮的性质,按下图所示装置进行实验。

请回答下列问题:
(1)装置甲中盛放浓硝酸的仪器A的名称是________,该装置中发生反应的化学方程式______________。
(2)实验过程中,装置乙、丙中出现的现象分别是_________________________、____________________;
装置丙中的试管内发生反应的离子方程式为:_____________________________________。
(3)为了探究NO的还原性,可以在装置丁的导气管C中通入一种气体,通入的这种气体的名称是______________________________。
(4)取下装置丙中的试管D,在其中滴加FeSO4溶液,溶液变为________色,为了证明铁元素在该反应中的产物,可以再在溶液中滴加KSCN溶液,溶液变为________色。
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中考试化学试卷(解析版) 题型:选择题
世界上60%的镁是从海水中提取的,其主要步骤如下:
①把贝壳制成石灰乳
②在海水中加入石灰乳,过滤,洗涤沉淀物
③将沉淀物与盐酸反应,结晶、过滤
④在氯化氢热气流中干燥晶体
⑤电解上述晶体的熔融物。
下列说法正确的是
A.镁元素在元素周期表中位于第4周期、第ⅡA族
B.向洗涤液中滴加碳酸钠溶液可检验沉淀是否洗涤干净
C.在氯化氢热气流中干燥晶体的目的是加快干燥速度
D.步骤⑤也可以采用电解该晶体水溶液的方法
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期第一次阶段考试化学试卷(解析版) 题型:选择题
向FeCl3和BaCl2的酸性混合溶液中,通入SO2气体,有白色沉淀生成。此沉淀是( )
A.BaSO4 B.FeS C.BaSO3 D.S
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com