
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:解答题

 ,F:CH3CHO.
,F:CH3CHO. ,
, .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,
,
 的同分异构体:
的同分异构体: 、
、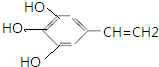 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 图如中所示化合物A(fumimycin)是从微生物中分离得到的它显示出广谱抗菌活性.下列关于化合物A的说法中,正确的是( )
图如中所示化合物A(fumimycin)是从微生物中分离得到的它显示出广谱抗菌活性.下列关于化合物A的说法中,正确的是( )| A. | 该化合物A的分子式为:C15H15O6N | |
| B. | 化合物A可以水解得到2种有机物 | |
| C. | 化合物A可与 H2发生加成反应,1molA最多消耗H22mol | |
| D. | 化合物A与足量的溴水反应,1molA可以消耗5molBr2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2能使酸性KMnO4溶液褪色,故CO2也能使酸性KMnO4溶液褪色 | |
| B. | Mg与CuSO4反应置换出Cu,故Na与CuSO4反应也可以置换出Cu | |
| C. | 次氯酸可以令有色布条褪色,因其强氧化性,故过氧化钠也可以令有色布条褪色 | |
| D. | SO2能使品红溶液褪色,故CO2也能使品红溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com