
ЎѕМвДїЎїДіСРѕїРЎЧй°ґПВБРВ·ПЯєПіЙТЅТ©ЦРјдМеXєНї№РДВЙТ©СОЛб°ўЖлАыМШЈє
IЎў
IIЎў
ТСЦЄЈє![]()
ЈЁ1Ј©ПВБРЛµ·ЁІ»ХэИ·µДКЗ_____
AЈ®AІ»ДЬ·ўЙъ»№Ф·ґУ¦ BЈ®XµД·ЦЧУКЅКЗC11H7ClO2
CЈ®EЎъFµД·ґУ¦ОЄИЎґъ·ґУ¦ DЈ®lmolСОЛб°ўЖлАыМШЧо¶аУл4molNaOH·ґУ¦
ЈЁ2Ј©c µД»ЇС§·ЅіМКЅ_____ЎЈ
µД»ЇС§·ЅіМКЅ_____ЎЈ
ЈЁ3Ј©DµДЅб№№јтКЅ_____ЎЈ
ЈЁ4Ј©Рґіц»ЇєПОпBЈЁ C6H4ClNO2Ј©·ыєПМхјюµДИэЦЦН¬·ЦТм№№МеµДЅб№№јтКЅ_____ЎЈ
ўЩ1H©ЃNMRЖЧ±нГч·ЦЧУЦРУР4ЦЦЗвФЧУЈ¬ўЪIRЖЧПФКѕУР±Ѕ»·ЎўNЈЅOјьґжФЪЎЈ
ЈЁ5Ј©![]() їЙУЙ CH3CH2OHЎўCH3NH2µИОпЦКєПіЙЈ¬ЗлЙијЖєПіЙВ·ПЯЈ¬ОЮ»ъКФјБЧФСЎЎЈ__________
їЙУЙ CH3CH2OHЎўCH3NH2µИОпЦКєПіЙЈ¬ЗлЙијЖєПіЙВ·ПЯЈ¬ОЮ»ъКФјБЧФСЎЎЈ__________
Ўѕґр°ёЎїAD 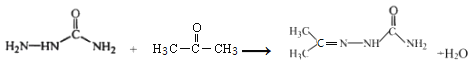

 Ўў
Ўў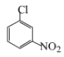 Ўў
Ўў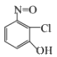 µИ CH3CH2OH
µИ CH3CH2OH![]() CH2=CH2
CH2=CH2![]() ClCH2CH2Cl
ClCH2CH2Cl![]()
![]()
ЎѕЅвОцЎї
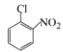
УЙєПіЙВ·ПЯїЙЦЄЈ¬±ЅєНВИЖш·ґУ¦ЙъіЙAЈ¬AОЄВИ±ЅЈ»A·ўЙъПх»Ї·ґУ¦ЙъіЙBЈ¬УЙXµДЅб№№їЙЦЄЈ¬BОЄ¶ФВИПх»щ±ЅЎЈ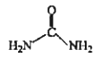 УлЛ®єПлВФЪјУИИµДМхјюПВЙъіЙµДCЈ¬ёщѕЭCµД·ЦЧУКЅїЙЦЄCОЄ
УлЛ®єПлВФЪјУИИµДМхјюПВЙъіЙµДCЈ¬ёщѕЭCµД·ЦЧУКЅїЙЦЄCОЄ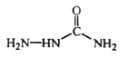 Ј»УЙРЕПў
Ј»УЙРЕПў![]() їЙЦЄЈ¬ CУл±ыНЄ·ўЙъ·ґУ¦ЙъіЙ
їЙЦЄЈ¬ CУл±ыНЄ·ўЙъ·ґУ¦ЙъіЙ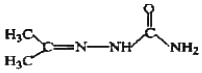 Ј»
Ј»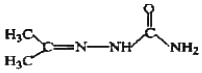 УлClCH2COOC2H5ФЪТТґјДЖµДЧчУГПВЙъіЙDЈ¬ёщѕЭDµД·ЦЧУКЅТФј°DУлСОЛб·ґУ¦µДІъОпµДЅб№№їЙЦЄЈ¬DОЄ
УлClCH2COOC2H5ФЪТТґјДЖµДЧчУГПВЙъіЙDЈ¬ёщѕЭDµД·ЦЧУКЅТФј°DУлСОЛб·ґУ¦µДІъОпµДЅб№№їЙЦЄЈ¬DОЄ Ј»УЙСОЛб°ўЖлАыМШµДЅб№№ДжFОЄ
Ј»УЙСОЛб°ўЖлАыМШµДЅб№№ДжFОЄ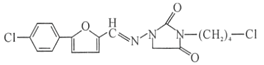 Ј»УЙFДжНЖEОЄ
Ј»УЙFДжНЖEОЄ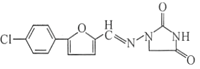 Ј»УЙEєН
Ј»УЙEєН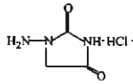 їЙТФНЖ¶ПXОЄ
їЙТФНЖ¶ПXОЄ![]() ЎЈ
ЎЈ
ЈЁ1Ј©AЈ®ОпЦКAОЄ![]() Ј¬±Ѕ»·ДЬУлЗвЖш·ўЙъјУіЙ·ґУ¦Ј¬КфУЪ»№Ф·ґУ¦Ј¬№КAґнОуЈ»BЈ®УЙXµДЅб№№
Ј¬±Ѕ»·ДЬУлЗвЖш·ўЙъјУіЙ·ґУ¦Ј¬КфУЪ»№Ф·ґУ¦Ј¬№КAґнОуЈ»BЈ®УЙXµДЅб№№![]() Ј¬їЙЦЄЖд·ЦЧУКЅКЗC11H7ClO2Ј¬№КBХэИ·Ј»
Ј¬їЙЦЄЖд·ЦЧУКЅКЗC11H7ClO2Ј¬№КBХэИ·Ј»
CЈ®EЎъFКЗEЦРHФЧУ±»©ЃЈЁCH2Ј©4ClМжґъЙъіЙFЈ¬КфУЪИЎґъ·ґУ¦Ј¬№КCХэИ·Ј»
DЈ®lmolСОЛб°ўЖлАыМШПаµ±УЪє¬УР2mol HClЈ¬ВИФЧУЛ®ЅвµГµЅ1mol HClЎў1mol·УфЗ»щЈ¬хЈ°·јьЛ®ЅвµГµЅ1molМјЛбєН1molЎЄCOOHЈ¬Чо¶аїЙТФУл7molNaOH·ґУ¦Ј¬№КDґнОуЈ¬
№КСЎЈєADЈ»
ЈЁ2Ј©CЎъ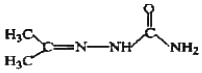 µД»ЇС§·ЅіМКЅОЄ
µД»ЇС§·ЅіМКЅОЄ Ј¬№Кґр°ёОЄЈє
Ј¬№Кґр°ёОЄЈє Ј»
Ј»
ЈЁ3Ј©DµДЅб№№јтКЅОЄЈє Ј¬№Кґр°ёОЄЈє
Ј¬№Кґр°ёОЄЈє Ј»
Ј»
ЈЁ4Ј©»ЇєПОпBКЗ¶ФВИПх»щ±ЅЈЁ C6H4ClNO2Ј©µДН¬·ЦТм№№Ме·ыєПМхјюЈєўЩ1H©ЃNMRЖЧ±нГч·ЦЧУЦРУР4ЦЦЗвФЧУЈ¬ўЪIRЖЧПФКѕУР±Ѕ»·ЎўNЈЅOјьґжФЪЈ¬·ыєПМхјюµДН¬·ЦТм№№МеУРЈє Ўў
Ўў Ўў
Ўў µИЈ¬№Кґр°ёОЄЈє
µИЈ¬№Кґр°ёОЄЈє Ўў
Ўў Ўў
Ўў µИЈ»
µИЈ»
ЈЁ5Ј©ТТґј·ўЙъПыИҐ·ґУ¦ЙъіЙТТП©Ј¬ТТП©УлВИЖш·ўЙъјУіЙ·ґУ¦ЙъіЙClCH2CH2ClЈ¬ЅбєПМвЦРРЕПўЈ¬ClCH2CH2ClЧоєу·Ц±рУлCH3CH2ClЎўNH3ЧчУõõЅДї±кОпЈ¬єПіЙВ·ПЯБчіМНјОЄЈєCH3CH2OH![]() CH2=CH2
CH2=CH2![]() ClCH2CH2Cl
ClCH2CH2Cl![]()
![]() ЎЈ№Кґр°ёОЄЈєCH3CH2OH
ЎЈ№Кґр°ёОЄЈєCH3CH2OH![]() CH2=CH2
CH2=CH2![]() ClCH2CH2Cl
ClCH2CH2Cl![]()
![]() ЎЈ
ЎЈ



| Дкј¶ | ёЯЦРїОіМ | Дкј¶ | іхЦРїОіМ |
| ёЯТ» | ёЯТ»Гв·СїОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СїОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СїОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СїОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СїОіМНЖјцЈЎ | іхИэ | іхИэГв·СїОіМНЖјцЈЎ |
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїєгОВМхјюПВЈ¬ФЪМе»эІ»±дµДГЬ±ХИЭЖчЦРЈ¬УРїЙДж·ґУ¦X(s)+2Y(g) ![]() 2Z(g) ЎчH<0Ј¬ПВБРЛµ·ЁЎЄ¶ЁХэИ·µДКЗ
2Z(g) ЎчH<0Ј¬ПВБРЛµ·ЁЎЄ¶ЁХэИ·µДКЗ
A. 0.2molXєН0.4molYід·Ц·ґУ¦Ј¬ZµДОпЦКµДБїїЙДЬ»бґпµЅ0.35mol
B. ґУИЭЖчЦРТЖіцІї·Ц·ґУ¦ОпXЈ¬ФтХэ·ґУ¦ЛЩВКЅ«ПВЅµ
C. µ±ЎчHІ»±дК±Ј¬·ґУ¦Ѕ«ґпµЅЖЅєв
D. Пт·ґУ¦МеПµЦРјМРшНЁИлЧгБїYЖшМеЈ¬XУРїЙДЬ±»·ґУ¦НкИ«
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїИзНјѕщОЄµз»ЇС§Ч°ЦГЈ¬ПВБРУР№ШРрКцХэИ·µДКЗ(ЎЎЎЎ)
A.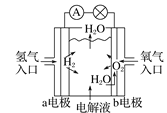 ЗвСхИјБПµзіШКѕТвНјЦРЈ¬bµзј«·ўЙъСх»Ї·ґУ¦
ЗвСхИјБПµзіШКѕТвНјЦРЈ¬bµзј«·ўЙъСх»Ї·ґУ¦
B. µзЅвВИ»ЇНИЬТєЧ°ЦГЦРЈ¬Мъ°фЙПОціцємЙ«№ММе
µзЅвВИ»ЇНИЬТєЧ°ЦГЦРЈ¬Мъ°фЙПОціцємЙ«№ММе
C. µз¶ЖКµСйЧ°ЦГЦРЈ¬Ифµз¶ЖЗ°БЅµзј«ЦКБїПаµИЈ¬µз¶ЖНкіЙєу¶юХЯЦКБїІоОЄ5.12 gЈ¬Фтµз¶ЖК±ґэ¶ЖМъЦЖЖ·У¦УлµзФґёєј«ПаБ¬Ј¬НвµзВ·ЧЄТЖ0.08 molµзЧУ
µз¶ЖКµСйЧ°ЦГЦРЈ¬Ифµз¶ЖЗ°БЅµзј«ЦКБїПаµИЈ¬µз¶ЖНкіЙєу¶юХЯЦКБїІоОЄ5.12 gЈ¬Фтµз¶ЖК±ґэ¶ЖМъЦЖЖ·У¦УлµзФґёєј«ПаБ¬Ј¬НвµзВ·ЧЄТЖ0.08 molµзЧУ
D. Ѕ»»»Д¤·ЁµзЅв±ҐєНNaClИЬТєФАнНјЦРЈ¬АлЧУЅ»»»Д¤У¦ОЄТхАлЧУЅ»»»Д¤
Ѕ»»»Д¤·ЁµзЅв±ҐєНNaClИЬТєФАнНјЦРЈ¬АлЧУЅ»»»Д¤У¦ОЄТхАлЧУЅ»»»Д¤
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїЈЁТ»Ј©ґјМю»ЇРВјјКхКЗЅьјёДкєПіЙ°±№¤Тµѕ»»Їѕ«Б¶ФБПЖшЈ¬іэИҐЙЩБїCOТ»ЦЦРВ·Ѕ·ЁЈ¬ЖдФАнїЙ·ЦОЄјЧґј»ЇУлјЧНй»ЇБЅёцІї·ЦЎЈ
јЧґј»ЇЈєCOЈЁgЈ©+2H2ЈЁgЈ©CH3OHЈЁgЈ©Ј©ЎчH1Јј©Ѓ116kJmol©Ѓ1
јЧНй»ЇЈєCOЈЁgЈ©+3H2ЈЁgЈ©CH4ЈЁgЈ©+H2OЈЁgЈ©ЎчH2Јј©Ѓ203kJmol©Ѓ1
ЈЁ1Ј©ПВБРґлК©УРАыУЪМбёЯґјМю»Ї№эіМCOЧЄ»ЇВКµДКЗ_____ЎЈ
AЈ®ј°К±·ЦАліцCH3OH BЈ®ККµ±ЙэёЯ·ґУ¦ОВ¶И
CЈ®К№УГёЯР§µДґЯ»ЇјБ DЈ®ККµ±ФцґуС№Зї
ЈЁ2Ј©јЧґј»ЇЖЅєвіЈКэ![]() ±нКѕЈ¬¦БОЄЖЅєвЧй·ЦЦРёчОпЦКµДОпЦКµДБї·ЦКэЎЈИфCOУлH2»мєПФБПЖшЦРCOµДМе»э·ЦКэОЄ1%Ј¬ѕјЧґј»ЇєуCOµДЖЅєвЧЄ»ЇВКОЄwЈ¬ФтK¦БЈЅ_____ЈЁУГє¬wµД±нґпКЅАґ±нКѕЈ©
±нКѕЈ¬¦БОЄЖЅєвЧй·ЦЦРёчОпЦКµДОпЦКµДБї·ЦКэЎЈИфCOУлH2»мєПФБПЖшЦРCOµДМе»э·ЦКэОЄ1%Ј¬ѕјЧґј»ЇєуCOµДЖЅєвЧЄ»ЇВКОЄwЈ¬ФтK¦БЈЅ_____ЈЁУГє¬wµД±нґпКЅАґ±нКѕЈ©
ЈЁ3Ј©ІвКФaЎўbБЅЦЦґЯ»ЇјБФЪІ»Н¬С№ЗїУлОВ¶ИМхјюПВЈ¬јЧґј»Ї№эіМЦРґЯ»ЇР§ВКИзНјЈє

ґУЙПНјїЙЦЄСЎФсДДЦЦґЯ»ЇјБЅПєГ_____ЈЁМоa»тbЈ©Ј¬АнУЙКЗ_____ЎЈ
ЈЁ4Ј©ПВБР№ШУЪґјМю»Ї№эіМЛµ·ЁХэИ·µДКЗ_____ЎЈ
AЈ®јЧґј»ЇУлјЧНй»Ї№эіМФЪИОєОМхјюПВѕщОЄЧФ·ў·ґУ¦
BЈ®СЎФсІ»Н¬µДґЯ»ЇјБїЙТФїШЦЖґјМю»Ї№эіМЦРЙъіЙјЧґјУлјЧНйµД°Щ·Цє¬Бї
CЈ®µ±ОВ¶ИУл·ґУ¦ИЭЖчМе»эТ»¶ЁК±Ј¬ФЪФБПЖшЦРјУИлЙЩБїµДЗДРФЖшМеЈ¬УРАыУЪМбёЯЖЅєвЧЄ»ЇВКУлјЧґјµДІъВК
DЈ®ККµ±Фцґу»мєПЖшМеЦРH2µД°Щ·Цє¬БїЈ¬УРАыУЪМбёЯґјМю»Ї№эіМCOЖЅєвЧЄ»ЇВК
ЈЁ¶юЈ©Ў°ОеЛ®№ІЦОЎ°КЗХгЅЦОЛ®µДіЙ№¦µд·¶Ј¬ЖдЦРє¬µЄ·ПЛ®ґ¦АнКЗОЫЛ®ЦОАнµДТ»ёцЦШТЄїОМвЈ¬Нј3КЗёЯє¬ЗиЈЁCN©ЃЈ©·ПЛ®ґ¦Ан·Ѕ°ёЈє

ЈЁ5Ј©ёЯє¬Зи·ПЛ®їЙТФНЁ№эµзЅв·ЁЅшРРґ¦АнЈ¬Сфј«·ґУ¦·ЦБЅёцЅЧ¶ОЈ¬µЪТ»ЅЧ¶Оµзј«·ґУ¦КЅЈєCN©Ѓ+2OH©Ѓ©Ѓ2e©ЃЈЅCNO©Ѓ+H2OЈ¬ЗлРґіцµЪ¶юЅЧ¶ОµДµзј«·ґУ¦КЅ_____ЎЈ
ЈЁ6Ј©µзЅвєуµНє¬Зи·ПЛ®НЁ№э»ЇС§Сх»Ї·Ѕ·Ёґ¦АнЈєФЪјоРФМхјюПВјУИлNaClOЈ¬Ѕ«CN©ЃСх»ЇОЄМјЛбСОУл¶Ф»·ѕіУСєГЖшМеЎЈЗлРґіцПа№ШАлЧУ·ґУ¦·ЅіМКЅ_____ЎЈ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїјЧґјЦКЧУЅ»»»Д¤ИјБПµзіШЦРЅ«јЧґјХфЖшЧЄ»ЇОЄЗвЖшµДБЅЦЦ·ґУ¦ФАнКЗ
ўЩ CH3OH(g)Ј«H2O(g)===CO2(g)Ј«3H2(g)Ј»¦¤HЈЅЈ«49.0 kJ/mol
ўЪ CH3OH(g)Ј«![]() O2(g)===CO2(g)Ј«2H2(g)Ј»¦¤HЈЅЈ192.9 kJ/mol
O2(g)===CO2(g)Ј«2H2(g)Ј»¦¤HЈЅЈ192.9 kJ/mol
ПВБРЛµ·ЁХэИ·µДКЗ ЈЁ Ј©
A. CH3OHµДИјЙХИИОЄ192.9 kJ/mol
B. ·ґУ¦ўЩЦРµДДЬБї±д»ЇИзНјЛщКѕ
C. CH3OHЧЄ±діЙH2µД№эіМТ»¶ЁТЄОьКХДЬБї
D. ёщѕЭўЪНЖЦЄ·ґУ¦ЈєCH3OH(l)Ј«![]() O2(g)===CO2(g)Ј«2H2(g)µД¦¤H>Ј192.9 kJ/mol
O2(g)===CO2(g)Ј«2H2(g)µД¦¤H>Ј192.9 kJ/mol
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїЧКБППФКѕЈє°±ЖшїЙФЪґїСхЦР°ІѕІИјЙХ![]() ДіРЈ»ЇС§РЎЧйС§ЙъЙијЖИзПВЧ°ЦГ
ДіРЈ»ЇС§РЎЧйС§ЙъЙијЖИзПВЧ°ЦГ![]() НјЦРМъјРµИјРіЦЧ°ЦГТСВФИҐ
НјЦРМъјРµИјРіЦЧ°ЦГТСВФИҐ![]() ЅшРР°±ЖшУлСхЖшФЪІ»Н¬МхјюПВ·ґУ¦µДКµСйЈ»
ЅшРР°±ЖшУлСхЖшФЪІ»Н¬МхјюПВ·ґУ¦µДКµСйЈ»

(1)°±Жшј«ТЧИЬУЪЛ®Ј¬ЖдЛ®ИЬТєЅРЧц°±Л®Ј¬ПФ______РФЈ¬ДЬК№КЇИпКФТє±д______Ј»ЖдФТтОЄ____________![]() УГ»ЇС§·ЅіМКЅєНµзАл·ЅіМКЅ±нКѕ
УГ»ЇС§·ЅіМКЅєНµзАл·ЅіМКЅ±нКѕ![]()
(2)НјјЧКЗКµСйКТЦЖИЎґїѕ»ЎўёЙФпµД°±ЖшµДЧ°ЦГНјЈ¬РґіцґуКФ№ЬДЪ·ўЙъ·ґУ¦µД»ЇС§·ЅіМКЅ![]() ІЙУГКµСйКТіЈУГТ©Ж·ЦЖ°±Жш
ІЙУГКµСйКТіЈУГТ©Ж·ЦЖ°±Жш![]() Јє______Ј¬AЦРЛщјУТ©Ж·ОЄ______Ј¬ЛщЖрЧчУГОЄ______Ј®
Јє______Ј¬AЦРЛщјУТ©Ж·ОЄ______Ј¬ЛщЖрЧчУГОЄ______Ј®
(3)Ѕ«ІъЙъµД°±ЖшУл№эБїµДСхЖшНЁµЅЧ°ЦГТТЦРЈ¬УГѕЖѕ«ЕзµЖјУИИєуЈ¬КФ№ЬДЪЖшМеОЄ______Й«Ј¬°±ґЯ»ЇСх»ЇµД»ЇС§·ЅіМКЅКЗ______
(4)Ѕ«№эБїµДСхЖшУлјЧІъЙъµД°±Жш·Ц±рґУaЎўbБЅ№ЬЅшЖшїЪНЁИлµЅЧ°ЦГ±ыЦРЈ¬ІўФЪb№ЬЙП¶ЛµгИј°±ЖшЈ¬ЖдСх»ЇІъОпОЄїХЖшµДЦчТЄіЙ·ЦЦ®Т»Ј»
![]() БЅЖшМеНЁИлµДПИєуЛіРтКЗ______Ј»
БЅЖшМеНЁИлµДПИєуЛіРтКЗ______Ј»![]() °±ЖшИјЙХµД»ЇС§·ЅіМКЅКЗ______Ј®
°±ЖшИјЙХµД»ЇС§·ЅіМКЅКЗ______Ј®
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎї¶ПБС1mol»ЇС§јьЛщРиТЄµДДЬБїИзПВ:
»ЇС§јь | N-N | O=O | NЎФN | N-H |
јьДЬkJЎ¤molЈ1 | a | 500 | 942 | 391 |
лВЈЁN2H4Ј©µДУР№Ш·ґУ¦ДЬБї±д»ЇИзНјЛщКѕЈ¬ПВБРЛµ·ЁХэИ·µДКЗЈЁ Ј©

A. ёГНј±нКѕ:1molN2H4Ул1molO2·ґУ¦ЙъіЙ1molN2єН2molH2O·ґУ¦ИИЎчH=Ј2752kJЎ¤molЈ1
B. a=154
C. N2(g)+2H2O(g)=N2H4(g)+O2(g) ЎчH=+2752kJЎ¤molЈ1
D. µ±УР2molH2O(g)ЙъіЙК±Ј¬·Еіц534kJЎ¤molЈ1µДИИБї
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїіфСхКЗАнПлµДСМЖшНСПхјБЈ¬ЖдНСПх·ґУ¦ОЄЈє2NO2(g)+O3(g)![]() N2O5(g)+O2(g)Ј¬·ґУ¦ФЪєгИЭГЬ±ХИЭЖчЦРЅшРРЈ¬ПВБРУЙёГ·ґУ¦Па№ШНјПсЧчіцµДЕР¶ПХэИ·µДКЗЈЁ Ј©
N2O5(g)+O2(g)Ј¬·ґУ¦ФЪєгИЭГЬ±ХИЭЖчЦРЅшРРЈ¬ПВБРУЙёГ·ґУ¦Па№ШНјПсЧчіцµДЕР¶ПХэИ·µДКЗЈЁ Ј©
A | B | C | D |
|
|
|
|
ЙэёЯОВ¶ИЈ¬ | 0Ў«3sДЪЈ¬·ґУ¦ЛЩВКОЄЈє | t1К±ЅцјУИлґЯ»ЇјБЈ¬ | ґпЖЅєвК±Ј¬ЅцёД±дxЈ¬ФтxОЄc(O2) |
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎї°ў·ьјУµВВЮіЈКэµДЦµОЄNAЎЈПВБРЛµ·ЁІ»ХэИ·µДКЗ
A.іЈОВіЈС№ПВЈ¬2 g D2O ЦРє¬ЦРЧУКэОЄNA
B.1mol±ЅТТП©ЈЁ![]() Ј©·ЦЧУЦРє¬УРМјМјЛ«јьµДёцКэОЄ4 NA
Ј©·ЦЧУЦРє¬УРМјМјЛ«јьµДёцКэОЄ4 NA
C.0.5molфЗ»щЦРЛщє¬µзЧУКэОЄ4.5NA
D.28gТТП©єН±ыП©ЈЁC3H6Ј©µД»мєПЖшМеє¬УРµДМјФЧУКэДїОЄ2NA
Ійїґґр°ёєНЅвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБР±н - КФМвБР±н
єю±±КЎ»ҐБЄНшОҐ·ЁєНІ»БјРЕПўѕЩ±ЁЖЅМЁ | НшЙПУРє¦РЕПўѕЩ±ЁЧЁЗш | µзРЕХ©ЖѕЩ±ЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРє¦РЕПўѕЩ±ЁЧЁЗш | ЙжЖуЗЦИЁѕЩ±ЁЧЁЗш
ОҐ·ЁєНІ»БјРЕПўѕЩ±Ёµз»°Јє027-86699610 ѕЩ±ЁУКПдЈє58377363@163.com