
 2C(g) ��֪����1mol A��2molB���ڴﵽƽ���������amolC����ʱC��ƽ�������е��������ΪM%.����ͬʵ�������£�
2C(g) ��֪����1mol A��2molB���ڴﵽƽ���������amolC����ʱC��ƽ�������е��������ΪM%.����ͬʵ�������£� ȫ��������ϵ�д�
ȫ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
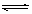 H2(g)��I2(g)�Ѵﵽƽ�����( )
H2(g)��I2(g)�Ѵﵽƽ�����( )�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2HBr(g)���ﵽƽ��ı�־��
2HBr(g)���ﵽƽ��ı�־��| A���������ѹǿ����ʱ��ı仯���ı� |
| B����λʱ��������2mol HBr��ͬʱ������1 mol H2 |
| C����λʱ��������2mol HBr��ͬʱ������1 mol H2 |
| D������Ӧ���淴Ӧ���ʶ���ȣ�������0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���ܹ�������ѧ��Ӧ����ײ����Ч��ײ |
| B������Ӧ���еij̶ȴ�����Ӧ����һ���� |
| C����Ӧ��������������������������ʱ���������ȷ�Ӧ |
| D����ѧƽ�ⷢ���ƶ�ʱ����ѧ��Ӧ����һ���仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�����¡���ѹʱ���백�� | B�����¡�����ʱ���뵪�� |
| C�����¡�����ʱ���뺤�� | D�����¡���ѹʱ���뺤�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 Si(s)+4HCl(g)
Si(s)+4HCl(g)  mol(Q��0)ij�¶ȡ�ѹǿ�£���һ������Ӧ��ͨ���ܱ������������Ϸ�Ӧ������������ȷ����
mol(Q��0)ij�¶ȡ�ѹǿ�£���һ������Ӧ��ͨ���ܱ������������Ϸ�Ӧ������������ȷ����| A����Ӧ�����У�������ѹǿ�����SiCl4��ת���� |
| B������Ӧ��ʼʱSiCl4Ϊ1 mol,���ƽ��ʱ����������ΪQ kJ |
| C����Ӧ��4 minʱ����HClŨ��Ϊ0.12 mol/L����H2�ķ�Ӧ����Ϊ0.03 mol/(L��min) |
| D������Ӧ��������Ϊ0.025Q kJʱ�����ɵ�HClͨ��100 mL 1 mol/L��NaOH��Һǡ�÷�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2Z(g)���¶ȷֱ�ΪT1��T2ʱ��X��ת���ʦ�(X) ��ʱ��仯�Ĺ�ϵ��ͼ�����н�����ȷ����
2Z(g)���¶ȷֱ�ΪT1��T2ʱ��X��ת���ʦ�(X) ��ʱ��仯�Ĺ�ϵ��ͼ�����н�����ȷ����
| A���÷�Ӧ����Ӧ���� |
| B���ﵽƽ��������������䣬ͨ��ϡ�����壬ƽ��������Ӧ�����ƶ� |
| C���ﵽƽ��������������䣬�����¶ȣ����淴Ӧ���ʾ���С��Z���������Ҳ��С |
| D����T2��ʱ������ʼ����1mol X��3mol Y��2mol Z���ﵽƽ����(X)��0.25 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
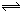 nC+D�ﵽƽ��ʱ������A��Ũ��Ϊw mol/L���������Ϊv%��
nC+D�ﵽƽ��ʱ������A��Ũ��Ϊw mol/L���������Ϊv%���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
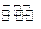 Na2S��s��+4H2O��g����
Na2S��s��+4H2O��g�����鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com