
下列离子方程式正确的是 ( )
A.三氯化铝溶液中加入过量氨水:Al3++3OH-===Al(OH)3↓
B.向含有0.2 mol FeI2的溶液中通入0.25 mol Cl2:8I-+2Fe2++5Cl2===10Cl-+4I2+2Fe3
C.K37ClO3与浓盐酸(HCl)在加热时生成Cl2:37ClO +6HCl===37Cl-+3Cl2↑+3H2O
+6HCl===37Cl-+3Cl2↑+3H2O
D.将0.1 mol/L盐酸数滴缓缓滴入0.1 mol/L 25 mL Na2CO3溶液中,并不断搅拌:2H++CO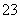 ===CO2↑+H2O
===CO2↑+H2O
科目:高中化学 来源: 题型:
(1)(4分)有下图所示A、B、C、D四种仪器:
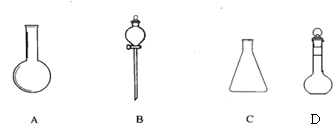 |
请选择下列仪器名称的序号,填入相应的空格内:
①烧杯 ②普通漏斗 ③圆底烧瓶 ④锥形瓶 ⑤分液漏斗 ⑥容量瓶
A ______________ B______________C______________D______________
(2)(4分)实验室检验某溶液中是否含有SO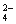 的操作方法是:
的操作方法是:
;
实验室检验某溶液中是否含有Cl-的操作方法是:
。
(3)(4分)选择下列实验方法分离物质,将分离方法的序号填在横线上。
A.萃取分液 B.升华 C.结晶 D.分液 E.蒸馏 F.过滤
(1)分离粗盐中混有的泥沙______。 (2)分离碘和水的混合物____ __。
(3)分离水和汽油的混合物______。 (4)分离酒精和水的混合物______。
查看答案和解析>>
科目:高中化学 来源: 题型:
可作为可逆反应 N2(g)+O2(g) 2NO(g)已达到平衡状态的标志的是( )
2NO(g)已达到平衡状态的标志的是( )
A.单位时间内每生成 n mol N2,同时生成2 n mol NO
B.容器内反应混合物的总压强不随时间改变
C.O2的消耗速率等于NO的消耗速率
D.容器内始终有N2、O2和NO共存
查看答案和解析>>
科目:高中化学 来源: 题型:
分类是化学研究中常用的方法。下列分类方法中,不正确的是 ( )
①根据元素原子最外层电子数的多少将元素分为金属和非金属
②根据电解质在水溶液中能否完全电离将电解质分为强电解质和弱电解质
③依据组成元素的种类,将纯净物分为单质和化合物
④根据酸分子中含有的氢原子个数,将酸分为一元酸、二元酸等
⑤根据氧化物中是否含有金属元素,将氧化物分为碱性氧化物、酸性氧化物
⑥根据分散系的稳定性 大小,将分散系分为胶体、浊液和溶液
大小,将分散系分为胶体、浊液和溶液
A.只有①③ B.③④⑤⑥ C.①④⑤⑥ D.全部正确
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W四种物质的转化关系如图所示。下列组合中不符合该关系的是( )
| A | B | C | D | |
| X | HCl | Na2O2 | Na2CO3 | SO2 |
| Y | FeCl2 | NaOH | CO2 | Na2SO3 |
| Z | Cl2 | Na2CO3 | CaCO3 | H2SO4 |
| W | FeCl3 | NaHCO3 | Ca(HCO3)2 | NaHSO3 |

查看答案和解析>>
科目:高中化学 来源: 题型:
有一澄清透明的溶液,只可能含有大量的Fe3+、Fe2+、H+、AlO2-、Al3+、CO32-、NO3-七种离子中的几种,向该溶液中逐滴加入一定量1 mol·L-1 NaOH溶液 的过程中,开始没有沉淀,而后才有沉淀。则下列判断正确的是( )
的过程中,开始没有沉淀,而后才有沉淀。则下列判断正确的是( )
A.溶液中可能含有AlO2- B.溶液中可能含有NO3-
C.溶液中一定不含Fe2+和Fe3+ D.溶液中可能含有Fe3+,但一定不含Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池。以下有关该原电池的叙述正确的是
①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag++e- =Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A.①② B.②③ C.②④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
现用质量分数为98%、密度为1.84g•cm﹣3的浓H2SO4来配制500mL0.2mol/L的稀H2SO4.
可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒⑥容量瓶 ⑦托盘天平 ⑧药匙.
请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时用到的有 (填代号).
(2)经计算,需浓H2SO4的体积为 5 .现有①10L ②50mL ③100mL三种规格的量筒,应选用的量筒是 (填代号).
(3)将浓H2SO4加适量蒸馏水稀释,冷却片刻,随后全部转移到 mL的容量瓶中,转移时应用玻璃棒 引流 .转移完毕,用少量蒸馏水洗涤 次,并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,振荡容量瓶,使溶液混合均匀.然后缓缓地把蒸馏水直接注入容量瓶直到液面接近刻度1﹣2cm处.改用 加蒸馏水到瓶颈刻度的地方,使溶液的凹面恰好与刻度相切.振荡、摇匀后,装瓶、贴签.
(4)在配制过程中,其他操作都准确,下列操作中:
能引起物质的量浓度偏低的是 ,能引起物质的量浓度偏高的有 (填代号).
①未等稀释后的硫酸冷却即转移到容量瓶中
②定容时,仰视刻度线
③转移前,容量瓶中含有少量蒸馏水.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com