
| A.电解液的质量增加x g | B.阴极质量增加x g |
| C.阴极质量增加a g ,a>x | D.阴极质量增加b g ,b<x |
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源:不详 题型:单选题
| A.1.5mol·L-1 | B.0.75mol·L-1 |
| C.0.5mol·L-1 | D.0.25mol·L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
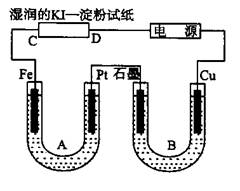
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | NaOH的质量分数 | 阳极析出物的质量/g | 阴极析出物的质量/g |
| A | 0.062(6.2%) | 19 | 152 |
| B | 0.062(6.2%) | 152 | 19 |
| C | 0.042(4.2%) | 1.2 | 9.4 |
| D | 0.042(4.2%) | 9.4 | 1.2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1.4 | B.5.6 | C.7 | D.12.6 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.阳极的电极反应式为:2Cl-→Cl2↑+2e- |
| B.阴极的电极反应式为:TiO2+4e-→Ti+2O2- |
| C.通电后,O2-、Cl-均向阴极移动 |
| D.石墨电极的质量不发生变化 |
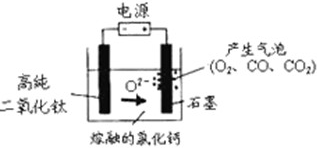
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
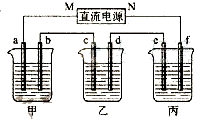
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com