
| A. | 在离子化合物中不可能存在非极性共价键 | |
| B. | 由电子定向移动而导电的物质一定是金属晶体 | |
| C. | 有键能很大的共价键存在的物质熔沸点一定很高 | |
| D. | 只含有共价键的物质不一定是共价化合物 |
分析 A.含有离子键的化合物是离子化合物,离子化合物中可能含有极性键或非极性键;
B.大多数物质导电都是靠电子定向移动的,不仅仅是金属;
C.只有在原子晶体中溶沸点与共价键强弱才呈正比关系,对于其它分子晶体来说并无关系;
D.只含共价键的物质不一定是共价化合物,可能是多原子单质.
解答 解:A.含有离子键的化合物是离子化合物,离子化合物中可能含有极性键或非极性键,如Na2O2,故A错误;
B.多数物质导电都是靠电子定向移动的,不仅仅是金属,如半导体材料硅等,故B错误;
C.分子晶体的熔沸点高低取决于分子间作用力的大小,与共价键的强弱无关,故C错误;
D.只含共价键的物质不一定是共价化合物,可能是多原子单质,如臭氧等,故D正确;
故选D.
点评 本题考查化学键知识,题目难度不大,注意常见物质的组成和结构特点,特别是化学键与分子间作用力的区别.


科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②③④⑥⑦ | C. | ②③⑤⑥⑦ | D. | ①②⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
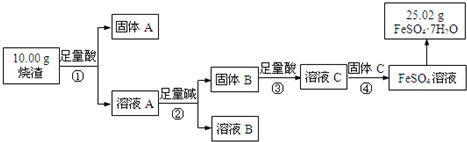
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光伏发电主要利用高纯度单质硅制成的硅太阳能电池 | |
| B. | 硅太阳能电池可将太阳能直接转化为电能,减少化石燃料的使用,保护环境 | |
| C. | 硅的结构和金刚石类似,是具有金属光泽的灰黑色固体 | |
| D. | 硅单质即能与氢氧化钠反应又能与氢氟酸反应,所以硅是两性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
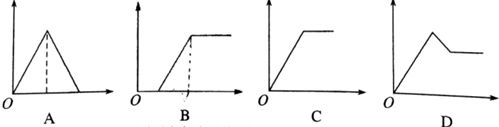
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述实验中不能用盐酸代替硫酸 | |
| B. | 将试管充分振荡后静置,溶液颜色变为紫色 | |
| C. | 在酸性条件下,PbO2的氧化性比MnO4-的氧化性强 | |
| D. | 若硫酸锰充分反应,消耗PbO2的物质的量为0.01mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.| I1 | I2 | I3 | I4 | … | |
| 电离能(kJ/mol) | 738 | 1451 | 7733 | 10540 | … |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测定蒸气的摩尔体积 | |
| B. | 与银氨溶液反应,分析产生银的量 | |
| C. | 与钠反应,分析产生氢气的量 | |
| D. | 用酸性高锰酸钾溶液滴定,分析相关数据 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2015年诺贝尔奖获得者屠呦呦提取的抗疟新药青蒿素的结构简式,用键线式表示如图.
2015年诺贝尔奖获得者屠呦呦提取的抗疟新药青蒿素的结构简式,用键线式表示如图. ,需要在有机合成中引入羟基,引入羟基的反应类型有①②⑤.(选填编号)
,需要在有机合成中引入羟基,引入羟基的反应类型有①②⑤.(选填编号)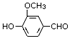 )可用于合成青蒿素,合成天然香草醛的反应如下:
)可用于合成青蒿素,合成天然香草醛的反应如下:
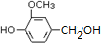 .
.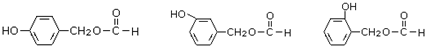 (其中之一).
(其中之一). 是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用).已知:羰基α-H可发生反应:
是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用).已知:羰基α-H可发生反应:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com