
| A. | c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+) | B. | c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-) | ||
| C. | c(Na+)=c(HS-)+2c(H2S)+2c(S2-) | D. | c(OH-)=c(H+)+c(HS-)+2c(H2S) |
分析 硫化钠溶液中,硫离子部分水解,溶液呈碱性,则c(OH-)>c(H+)、c(Na+)>c(S2-),氢氧根离子来自水的电离和硫离子的水解,则c(OH-)>c(HS-),溶液中离子浓度大小为:c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+);硫化钠溶液中还存在电荷守恒c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-)、物料守恒c(Na+)=2c(HS-)+2c(H2S)+2c(S2-)、质子守恒c(OH-)=c(HS-)+c(H+)+2 c(H2S),据此进行判断.
解答 解:A.硫离子部分水解,溶液呈碱性,则c(OH-)>c(H+)、c(Na+)>c(S2-),氢氧根离子来自水的电离和硫离子的水解,则c(OH-)>c(HS-),溶液中离子浓度大小为:c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+),故A正确;
B.硫化钠水溶液中存在电荷守恒,阳离子所带正电荷的浓度和等于阴离子所带的负电荷的浓度和,即:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-),故B错误;
C.硫化钠水溶液中存在物料守恒,钠元素和硫元素物质的量之比为2:1,溶液中物料守恒为:c(Na+)=2 c(S2-)+2 c(HS-)+2 c(H2S),故C错误;
D.硫化钠水溶液中存在质子守恒:c(OH-)=c(HS-)+c(H+)+2 c(H2S),故D正确;
故选AD.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理、电荷守恒、物料守恒、质子守恒的含义及应用方法为解答关键,注意熟练掌握判断离子浓度大小的方法.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
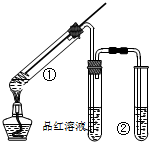 用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应的产物,下列有关说法不正确的是( )
用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应的产物,下列有关说法不正确的是( )| A. | 浓硫酸既表现了强氧化性,又表现了酸性 | |
| B. | 品红溶液的作用是吸收SO2,防止空气污染 | |
| C. | 该实验体现环境保护和节约化学试剂的理念 | |
| D. | 装置②中盛放的试剂可能NaOH是溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 判断H2O2分解速率的大小,可以通过测定单位时间内H2O2分解放出的O2的体积 | |
| B. | 制摩尔盐时用酒精洗涤产品 | |
| C. | 用米汤直接检验食用盐中是否含有碘元素 | |
| D. | 以硝酸钠和氯化钾为原料可以制备硝酸钾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解稀硫酸溶液,实质上是电解水,故溶液pH不变 | |
| B. | 电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小 | |
| C. | 电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1:2 | |
| D. | 电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | M层电子数比K层电子数多4个 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯、乙烯都既能发生加成反应,也能发生氧化反应 | |
| B. | 塑料、橡胶和合成纤维都属于有机高分子化合物 | |
| C. | 糖类、脂肪和蛋白质在一定条件下都能发生水解反应 | |
| D. | 分子式为C5H12的有机物有三种,它们属于同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | 只有①③ | C. | 只有②③ | D. | 只有① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com