
科目:高中化学 来源:2016届重庆市高三上学期9月月考化学试卷(解析版) 题型:填空题
(15分)铝是地壳中含量最多的金属元素,铝及其化合物应用日趋广泛。
(1)铝的原子结构示意图是
(2)氧化铝是两性氧化物,写出其与NaOH溶液反应的化学方程式
(3)工业上常用铝土矿(含SiO2等杂质)生产铝。从Na2SiO3和NaAlO2混合溶液中制得Al(OH)3,需要从下列试剂中选择两种,选用的试剂组合最好是 。
a. NaOH溶液 b. CO2 c. 氨水 d. 盐酸
最终获得铝单质是电解 (填化学式),电解过程中加入冰晶石的作用是
(4)下图表示将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系(已知Ba(AlO2)2:可溶),最先与CO2反应的物质是 ,ab段反应的离子方程式为
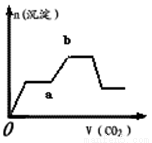
(5)某Mg-Al合金是一种潜在的储氢材料。73.2g该合金恰好溶解于1.4 L 5. 0mol·L-1 HCl溶液,则合金中Mg和Al的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高二10月月考化学试卷(解析版) 题型:选择题
在一定温度下,反应2SO2+O2 2SO3 达到平衡时,n(SO2)∶n(O2)∶n(SO3 )=2∶3∶4,缩小体积,反应再次达到平衡。n(O2)=0.8 mol,n(SO3 )=1.4 mol,此时SO2的物质的量为 ( )
2SO3 达到平衡时,n(SO2)∶n(O2)∶n(SO3 )=2∶3∶4,缩小体积,反应再次达到平衡。n(O2)=0.8 mol,n(SO3 )=1.4 mol,此时SO2的物质的量为 ( )
A.0.4 mol B.0.6 mol C.0.8 mol D.1.2 mol
查看答案和解析>>
科目:高中化学 来源:2016届贵州省遵义市高三上学期第一次联考化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列说法正确的是
A.24.5L氢气中所含氢原子数一定大于2NA
B.lmolCH3+电子数为9NA
C.l00g 60%CH3COOH水溶液中含有的分子数为NA
D.常温常压下0.lmol CO和NO的混合气体含氧原子数为0.lNA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年海南华侨中学高二上会考模拟化学试卷(解析版) 题型:填空题
坐落在山东沿海地区的潍坊纯碱厂是我国重点大型企业,其生产工艺沿用我国化学侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:
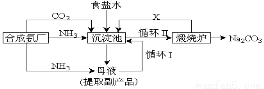
①上述生产纯碱的方法称 ,副产品的一种用途为 。
②沉淀池中发生的化学反应方程式是 。
③写出上述流程中X物质的分子式 。
④使原料氯化钠的利用率从70%提高到90%以上,主要是设计了 (填上述流程中的编号)的循环。
⑤向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 。
A.增大NH4+的浓度,使NH4Cl更多地析出
B.使NaHCO3更多地析出
C.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
查看答案和解析>>
科目:高中化学 来源:2015-2016学年海南华侨中学高二上会考模拟化学试卷(解析版) 题型:选择题
能用离子方程式“Ba2+ +SO4 2—==BaSO4↓”表示的化学反应是
A.Ba(OH)2+H2SO4==BaSO4↓+2H2O
B.Na2CO3+H2SO4==Na2SO4+H2O+CO2↑
C.BaCl2+H2SO4==BaSO4↓+2HCl
D.Zn+H2SO4==ZnSO4+H2↑
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上学期第一次月考化学试卷(解析版) 题型:选择题
下列描述中,不符合生产实际的是
A.电解法精炼粗铜,用粗铜作阳极
B.电解熔融的氧化铝制取金属铝,用铁作阳极
C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D.在镀件上电镀锌,用锌作阳极
查看答案和解析>>
科目:高中化学 来源:2016届江苏省无锡市高三上学期10月月考化学试卷(解析版) 题型:填空题
(14分)以硫铁矿(主要成分为FeS2)为原料制取硫酸,其烧渣可用来炼铁。
(1)煅烧硫铁矿时发生反应:FeS2+O2―→Fe2O3+SO2(未配平)。当产生448 L(标准状况)SO2时,消耗O2的物质的量为____________。
(2)Fe2O3用CO还原焙烧的过程中,反应物、生成物和温度之间的关系如图所示。
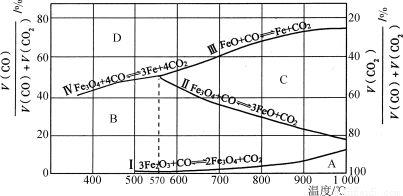
(图中Ⅰ、Ⅱ、Ⅲ、Ⅳ四条曲线是四个化学反应平衡时的气相组成对温度作图得到的;A、B、C、D四个区域分别是Fe2O3、Fe3O4、FeO、Fe稳定存在的区域)
已知:3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g);ΔH1=a kJ·mol-1
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g);ΔH2=b kJ·mol-1
FeO(s)+CO(g)===Fe(s)+CO2(g);ΔH3=c kJ·mol-1
① 反应Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g)的ΔH=____________kJ·mol-1(用含a、b、c的代数式表示)。
② 800 ℃时,混合气体中CO2体积分数为40%时,Fe2O3用CO还原焙烧反应的化学方程式为__________________。
③ 据图分析,下列说法正确的是___________ (填字母)。
a. 温度低于570℃时,Fe2O3还原焙烧的产物中不含FeO
b. 温度越高,Fe2O3还原焙烧得到的固体物质组成中Fe元素的质量分数越高
c. Fe2O3还原焙烧过程中及时除去CO2有利于提高Fe的产率
(3) FeS2是Li/FeS2电池(示意图如图)的正极活性物质。
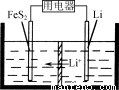
① FeSO4、Na2S2O3、S及H2O在200 ℃时以等物质的量连续反应24 h后得到FeS2。写出该反应的离子方程式: 。
② Li/FeS2电池的负极是金属Li,电解液是含锂盐的有机溶液。电池放电反应为FeS2+4Li===Fe+4Li++2S2-。该反应可认为分两步进行:第1步,FeS2+2Li===2Li++FeS22-,则第2步正极的电极反应式为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com