
| A. | 干冰、液态氯化氢都是电解质 | |
| B. | Na2O、Fe2O3、Al2O3既属于碱性氧化物,又属于离子化合物 | |
| C. | 硫酸、烧碱、纯碱、生石灰分别属于酸、碱、盐、氧化物 | |
| D. | 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |
分析 A、在水溶液中或熔融状态下能导电的化合物为电解质;
B、能和酸反应生成盐和水的氧化物为碱性氧化物;由阴阳离子构成的为离子化合物;
C、电离出的阳离子全部是氢离子的化合物为酸;电离出的阴离子全部是氢氧根的化合物为碱;阳离子是金属阳离子或铵根离子、阴离子是酸根离子的化合物为盐;由两种元素构成、其中一种为氧元素的化合物为氧化物;
D、溶液、浊液和胶体的本质区别是分散质粒子直径大小.
解答 解:A、在水溶液中或熔融状态下能导电的化合物为电解质,而二氧化碳在水溶液中和熔融状态下均不能导电,故为非电解质,故A错误;
B、能和酸反应生成盐和水的氧化物为碱性氧化物,而氧化铝既能和酸反应又能和碱反应生成盐和水,故为两性氧化物,故B错误;
C、电离出的阳离子全部是氢离子的化合物为酸,故硫酸为酸;电离出的阴离子全部是氢氧根的化合物为碱,故烧碱即NaOH为碱;阳离子是金属阳离子或铵根离子、阴离子是酸根离子的化合物为盐,故纯碱即碳酸钠为盐;由两种元素构成、其中一种为氧元素的化合物为氧化物,故生石灰即CaO为氧化物,故C正确;
D、溶液、浊液和胶体的本质区别是分散质粒子直径大小,丁达尔效应是胶体所特有的性质,故D错误.
故选C.
点评 本题考查了电解质、酸、碱、盐和氧化物以及碱性氧化物的概念,难度不大,应注意的是氧化铝为两性氧化物而非碱性氧化物.


 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L乙醇中含有的碳氢键数为2.5NA | |
| B. | 4.6g由NO2和N2O4组成的混合物中含有氧原子的数目为0.2NA | |
| C. | 常温下,pH=12的Na2CO3溶液中含有的OH-离子数为0.2NA | |
| D. | 标准状况下,2.24 L Cl2与足量的NaOH溶液反应,转移的电子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2L氧气所含有的原子数目为NA | |
| B. | 9g水所含有的电子数目为0.5NA | |
| C. | 1mol氢分子含有的电子数目为NA | |
| D. | 0.1molCH4含有的质子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a:2b | B. | a:(a+2b) | C. | a:2(a+b) | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
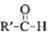 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$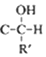
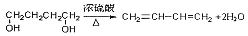 ,其反应类型消去反应.
,其反应类型消去反应.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
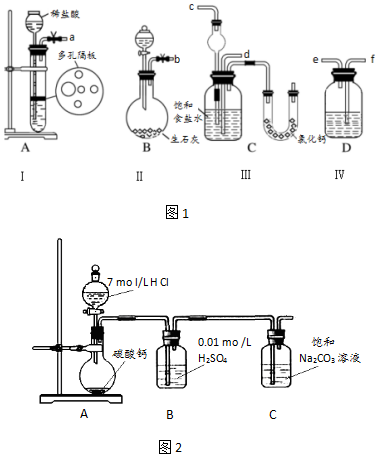
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 ;反应类型加聚反应;
;反应类型加聚反应;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用红色石蕊试纸检验溶液的酸性 | |
| B. | 过滤时,为了加速溶液透过滤纸,可以用玻璃棒末端轻轻搅拌滤纸上的混合物 | |
| C. | 测定某溶液的pH时,先用蒸馏水润湿pH试纸,再用洁净、干燥的玻璃棒蘸取该溶液,点在试纸上,并与标准比色卡比较 | |
| D. | 容量瓶用于配制一定体积、一定浓度的溶液,不能作为反应容器使用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com