
分析 (1)根据配制200mL0.1mol/L的酸性KMnO4溶液的步骤判断需要仪器;根据玻璃棒在配制过程中的作用解答;
(2)根据空气中的固体尘粒容易被溶液吸收进行判断;
(3)二氧化硫具有还原性,容易被酸性高锰酸钾溶液氧化成硫酸根离子,据此写出反应的离子方程式;根据反应方程式及空气流速、高锰酸钾溶液浓度计算出空气中二氧化硫的含量;
解答 解:(1)配制200mL0.1mol•L-1酸性KMnO4溶液,由于实验室没有200mL容量瓶,应用250mL容量瓶配制,需用托盘天平称量高锰酸钾固体,在烧杯中加水溶解并用玻璃棒搅拌,冷却后用玻璃棒转移至容量瓶中,玻璃棒的作用是引流,加水至溶液离刻度线1~2cm时改用胶头滴管滴加至刻度线,还缺少的仪器为:托盘天平、250mL容量瓶;玻璃棒在溶解高锰酸钾溶液固体时起到搅拌、加速溶解的作用,在转移溶液时用玻璃棒引流,
故答案为:250mL容量瓶;托盘天平;搅拌;
(2)在测定SO2和可吸入颗粒时,由于空气中的固体尘粒容易被其它溶液吸收,所以首先应测定可吸入颗粒,
故答案为:可吸入颗粒;
(3)SO2具有还原性,高锰酸钾具有氧化性,二者发生氧化还原反应生成SO42-和Mn2+离子,反应的离子方程式为:5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+;
高锰酸钾的物质的量为:0.2L×0.1moL/L=0.02moL,当t min时,通过空气的体积为:at mL,
根据反应方程式5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+可知,at ml空气中含有SO2的物质的量为 $\frac{5}{2}$×0.02mol=0.05mol,
二氧化硫的质量为:0.05mol×64g/moL=3.2g,
所以空气中SO2的含量为:$\frac{3.2}{at}$g/cm3,
故答案为:5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+;$\frac{3.2}{at}$;
点评 本题考查了探究空气中二氧化碳含量的方法、配制一定物质的量浓度的溶液,题目难度中等,注意掌握探究物质组成或测量物质含量的方法,明确配制一定浓度的溶液方法,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 氮及其化合物与人类生产、生活息息相关.回答下列问题:
氮及其化合物与人类生产、生活息息相关.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2(g)+3H2(g)?2NH3(g) (正反应为放热反应) | |
| B. | C(s)+CO2(g)?2CO(g) (正反应为吸热反应) | |
| C. | 2NO2(g)?N2O4(g) (正反应为放热反应) | |
| D. | 3O2(g)?2O3(g) (正反应为吸热反应) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含盐酸的酸性废水,用中和法处理 | |
| B. | 含Cu2+、Fe3+的废水,用沉淀法处理 | |
| C. | 混凝法是处理污水中细小悬浮颗粒污染物的常用方法 | |
| D. | 含有重金属离子的废水用明矾处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
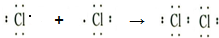 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gD2O含电子数目为10NA | |
| B. | 标准状况下,NA个HF分子所占的何种约为22.4L | |
| C. | 4.5g SiO2晶体中含有的硅氧键的数目为0.3NA | |
| D. | 常温下将0.1mol铁片放入足量浓硝酸中反应后,转移电子的数目为0.3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com