
| A、将水加热到100℃时,水的pH=6 |
| B、向水中滴加少量稀硫酸 |
| C、向水中滴加少量NaHCO3 |
| D、向水中加入少量硫酸铜晶体 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol甲醇中含有C-H键的数目为4NA |
| B、25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA |
| C、常温下,18g重水(D2O)所含的电子数为10NA |
| D、一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、NaAlH4中氢元素为+1价 |
| B、每生成11.2 L(标准状况下)H2,转移2NA个电子 |
| C、在反应中有50%的氢被氧化 |
| D、反应中氧化产物与还原产物的物质的量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,1.06gNa2CO3含有的Na+离子数为0.02 NA |
| B、标准状况下,0.5 mol/LBaCl2溶液中含有Cl-离子数为NA |
| C、通常状况下,NA个CO2分子占有的体积为22.4L |
| D、2.7g铝与盐酸完全反应失去0.2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3+、NO3-、K+、Cl- |
| B、NH4+、Mg2+、SO42-、Cl- |
| C、Na+、Al3+、OH-、CO32- |
| D、K+、Na+、NO3-、MnO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由于氧化性HNO3大于H2SO4,所以非金属性:氮大于硫 |
| B、科学家在金属和非金属交界线处寻找催化剂 |
| C、只有主族元素是由短周期和长周期元素共同构成的 |
| D、长周期主族元素X的阳离子X2+的最外层有2个电子,则它是IVA族元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
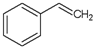 )的叙述,错误的是( )
)的叙述,错误的是( )| A、可以与溴水反应 |
| B、能够使酸性高锰酸钾溶液褪色 |
| C、分子式C8H8 |
| D、1mol苯乙烯可以和1molH2发生加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com