
【题目】某同学称取一定质量的MgCl2固体配成溶液,在该溶液中加入一定量的稀盐酸,然后向此混合溶液中逐滴加入NaOH溶液(如图甲所示).滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图乙所示.请回答下列问题: 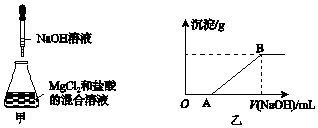
(1)溶解MgCl2固体需要的玻璃仪器有(填字母). a.天平b.烧杯c.漏斗d.玻璃棒
(2)AB段反应的离子方程式为 .
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列方案不能达到实验目的的是( )
A.用闻气味的方法鉴别CO2和CO
B.用pH试纸鉴别NaCl溶液与HCl溶液
C.用品红溶液鉴别SO2和CO2
D.用激光笔照射的方法鉴别溶液和胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学实验事实及其解释都正确的是( )
A. 过量的铜屑与稀硝酸作用,反应停止后,再加入1 mol/L稀硫酸,铜屑又逐渐溶解是因为铜 可直接与1 mol/L稀硫酸反应
B. 粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌比纯锌还原性强
C. 铁钉放在浓硝酸中浸泡后,再用蒸馏水冲洗,然后放入CuSO4溶液中不反应,说明铁钉表面 形成了一层致密稳定的氧化膜
D. 工业制玻璃的主要反应之一:Na2CO3+SiO2高温Na2SiO3+CO2↑,该反应原理可用“强酸H2CO3制弱酸H2SiO3”来解释
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4,溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。 回答下列问题:

(1)外电路的电流方向是由________极流向________极(填字母)。
(2)电池正极反应式为___________________________________。
(3)是否可用水代替电池中的混合有机溶剂?________(填“是”或“否”),原因是________________________________________________________________。
(4)MnO2可与KOH和KClO3在高温下反应,生成K2MnO4,反应的化学方程式为_______________________________________________。K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答问题
(1)NaHSO4与NaHCO3溶液反应离子方程式 .
(2)KClO3+6HCl═KCl+3Cl2↑+3H2O ①氧化剂与还原剂的物质的量的比为 .
②氧化产物与还原产物的物质的量的比 .
(3)已知下面三个反应:2Fe2++Cl2=2Fe3++2Cl﹣;2Fe2++Br2═2Fe3++2Br﹣; 2Br﹣+Cl2═Br2+2Cl﹣①根据以上三个反应,判断还原剂的还原性由强到弱的顺
②写出氯气和溴化亚铁以物质的量之比为3:4的离子反应方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”。为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。

部分含钒物质在水中的溶解性如下表所示:
物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
请回答下列问题:
(1)请写出加入Na2SO3溶液发生反应的离子方程式__________________________。
(2)催化氧化所使用的催化剂钒触媒(V2O5)能加快二氧化硫氧化速率,此过程中产生了一连串的中 间体(如图)。其中a、c二步的化学方程式可表示为__________________________,____________________________________。

(3)该工艺中沉矾率是回收钒的关键之一,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。

根据图试建议控制氯化铵系数和温度:_____________、______________。
(4)经过热重分析测得:NH4VO3在焙烧过程中,固体质量的减少值(纵坐标)随温度变化的曲线如
图所示。则NH4VO3在分解过程中____________。

A.先分解失去H2O,再分解失去NH3
B.先分解失去NH3,再分解失去H2O
C.同时分解失去H2O和NH3
D.同时分解失去H2、N2和H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于相同物质的量的SO2和SO3,下列说法中一定正确的是( )
A. 硫元素的质量比为5∶4 B. 分子数之比为1∶1
C. 原子总数之比为4∶3 D. 体积之比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取镁是世界各国获得镁的主要来源,以下是制取镁的过程中涉及的几种物质的溶度积,根据你所学的知识回答下列几个问题:
物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 |
溶度积 | 2.8×10-9 | 6.8×10-6 | 5.5×10-6 | 1.8×10-11 |
(1)在从海水中提取镁时,往往用到贝壳(主要成份是碳酸钙),你认为____(填“能”或“不能”)将贝壳研磨成粉末直接投入海水中,理由是____;如果不能直接投入,应将贝壳作何处理____,试写出化学方程式_______。
(2)某同学在实验室条件下模拟该生产过程,但实验室无石灰,他打算用烧碱代替,你认为_______(填“可以”或“不可以”)得到Mg(OH)2。在加试剂时,误将纯碱溶液加入海水中,他思考了一下,又在得到的混合体系中加入过量的烧碱溶液,你觉得他___(填“能”或“不能”)将Mg2+转化为Mg(OH)2沉淀,理由是________。(用离子方程式表示)
(3)已知海水中镁离子浓度为1.8×10-3mol/L,则要使镁离子产生沉淀,溶液的pH最低应为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com