
【题目】实验室用图示装置制取乙酸乙酯。
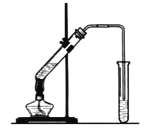
(1)浓H2SO4的作用是:___、___。
(2)右边收集试管内装有___,该溶液的作用是___。导气管不能插入液面以下,原因是___。加热前,大试管中加入几粒碎瓷片的作用是___。
(3)从右边收集试管内分离出乙酸乙酯的方法是___。
(4)实验室可用乙醇来制取乙烯,将生成的乙烯通入溴的四氯化碳溶液,反应后生成物的结构简式是___。
【答案】催化剂 吸水剂 饱和碳酸钠溶液 除去挥发出来的乙酸和乙醇,减小乙酸乙酯溶解度,有利于分层 防止倒吸 防止暴沸 分液 CH2BrCH2Br
【解析】
(1)浓硫酸具有吸水性、脱水性、强氧化性等特性,结合反应即可解答;
(2)饱和碳酸钠溶液吸收乙醇、与乙酸反应除去乙酸,同时降低乙酸乙酯的溶解度,便于分层;导管伸入液面下可能发生倒吸;液体加热要加碎瓷片,防止暴沸;
(3)乙酸乙酯不溶于水,密度比水小;
(4)乙烯使溴水褪色是因为乙烯和溴水中的溴单质发生了加成反应。
(1)乙酸与乙醇发生酯化反应,需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,浓硫酸的作用为催化作用,吸水作用,故答案为:催化剂;吸水剂;
(2)制备乙酸乙酯时常用饱和碳酸钠溶液收集乙酸乙酯,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯;导管不能插入溶液中,导管要在饱和碳酸钠溶液的液面上,伸入液面下可能发生倒吸;加热液体时要加碎瓷片,作用是防止暴沸,故答案为:饱和碳酸钠溶液;除去挥发出来的乙酸和乙醇,减小乙酸乙酯溶解度,有利于分层;防止倒吸;防止暴沸;
(3)乙酸乙酯不溶于水,密度比水小,则分离饱和碳酸钠溶液和乙酸乙酯的方法是分液,故答案为:分液;
(4)将生成的乙烯通入溴的四氯化碳溶液,乙烯与溴发生加成反应生成1,2-二溴乙烷,反应的化学方程式为CH2=CH2+Br-Br![]() CH2Br-CH2Br,故答案为:
CH2Br-CH2Br,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是( )
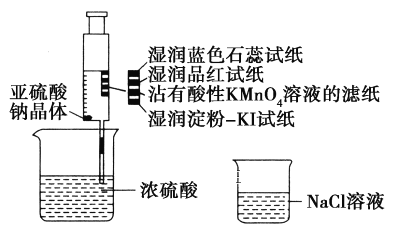
A. 蓝色石蕊试纸先变红后褪色
B. 品红试纸、沾有酸性KMnO4溶液的滤纸均褪色,证明SO2具有漂白性
C. 湿润淀粉-KI试纸未变蓝说明SO2的氧化性弱于I2
D. NaCl溶液可用于除去实验中多余的SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A. 向0.1mol/LCH3COOH溶液中加入少量水,溶液中c(H+)/c(CH3COOH)减小
B. 将CH3COONa溶液从20℃升温至30℃,溶液中c(CH3COO-)/c(CH3COOH)·c(OH-)增大
C. 向盐酸中加入氨水至中性,溶液中c(NH4+)/c(Cl-)>1
D. 向AgCl、AgBr的饱和溶液中加入少量硝酸银,溶液中c(Cl-)/c(Br-)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气作为清洁能源有着广泛的应用前景,含硫天然气制备氢气的流程如图。

请回答下列问题:
Ⅰ.转化脱硫:将天然气压入吸收塔,30℃时,在T·F菌作用下,酸性环境中脱硫过程示意图如图。
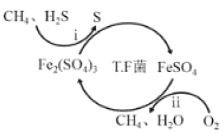
过程i的离子反应方程式为_____。
已知:①Fe3+在pH=1.9时开始沉淀,pH=3.2时沉淀完全。
②30℃时,在T·F菌作用下,不同pH的FeSO4溶液中Fe2+的氧化速率如表。
pH | 0.7 | 1.1 | 1.5 | 1.9 | 2.3 | 2.7 |
Fe2+的氧化速率 | 4.5 | 5.3 | 6.2 | 6.8 | 7.0 | 6.6 |
在转化脱硫中,请在表中选择最佳pH范围是____<pH<____,这样选择的原因是:______。
Ⅱ.蒸气转化:在催化剂的作用下,水蒸气将CH4氧化。结合如图回答问题。
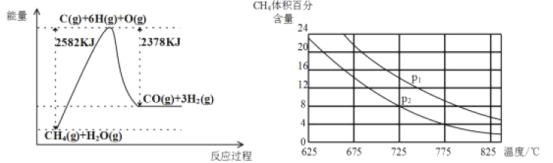
(3)①该过程的热化学方程式是_____。
②比较压强P1和P2的大小关系:P1____P2(选填“<”、“>”或“=”)。
Ⅲ.CO变换:500℃时,CO进一步与水反应生成CO2和H2。
Ⅳ.提纯:将CO2和H2分离得到H2的过程如示意图如图。
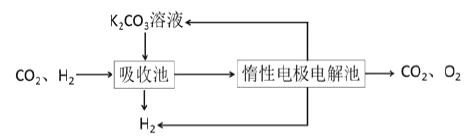
(4)吸收池中发生反应的离子方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子中中心原子的杂化方式和分子的空间构型均正确的是( )
A. C2H2:sp2、直线形
B. SO42-:sp3、三角锥形
C. H3O+:sp3、V形
D. BF3:sp2、平面三角形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的五种短周期主族元素,其中仅含有一种金属元素,A单质试自然界中密度最小的气体,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成A2C和A2C2两种常见的液态化合物.请回答下列问题:
(1)A元素的名称是____,D在周期表中的位置______.E的离子结构示意图___.
(2)B2分子的电子式:__,A2C的结构式:______.
(3)用电子式表示D2E化合物的形成过程为__.
(4)用含A元素最简单的有机化合物与赤热的氧化铜反应生成一种单质、液态氧化物和一可以使澄清石灰水变浑浊的气体,其化学方程式为_______.
(5)在100mL 18mol/L E的最高价氧化物对应水化物的溶液中加入过量的铜片,加热使之充分反应,铜片部分溶解.产生的气体在标准状况下的体积可能是____(填序号)
a.7.32L b.6.72L c.20.16L d.30.24L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)硫酸镍溶于过量的氨水可形成[Ni(NH3)6]SO4溶液。
①[Ni(NH3)6]SO4中Ni2+与NH3之间形成的化学键称为_____,中心原子(离子)是____;
②SO42-中,中心原子的轨道杂化类型为_______;
③写出一种与SO42-互为等电子体的分子的化学式______;
(2)NH3极易溶于水,除因为它们都是极性分子外,还因为__________。
(3)已知H—H键能为436kJ/mol,N≡N键的键能为945kJ/mol,根据化学方程式:N2+3H2 ==2NH3 ΔH=-92.4kJ/mol,则H—N键能为____kJ/mol。
(4)下列分子既存在p-sp σ键,也存在p-p π键的是_____。
A.NH3 B.H2 C.CO2 D.C2H2
(5)根据已经掌握的共价键知识判断,键的极性N—H___O—H(“>”,“=”或“<”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胡椒酚是植物挥发油中的一种成分。关于胡椒酚的下列说法:
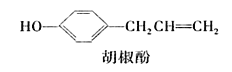
①该化合物属于芳香烃;
②分子中至少有7个碳原子处于同一平面;
③它的部分同分异构体能发生银镜反应;
④1 mol该化合物最多可与2 mol Br2发生反应。其中正确的是( )
A. ①③B. ①②④C. ②③D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 碳燃烧的热化学方程式为C(s)+1/2O2(g)=CO(g) ΔH=+110.5kJ·mol-1
B. 镀锌铁皮发生电化学腐蚀时,负极反应式为:Zn-2e–= Zn2+
C. NaHS水解的离子方程式是:HS﹣+H2O![]() S2﹣+H3O+
S2﹣+H3O+
D. 溶液中碳酸的电离方程式为:H2CO3![]() 2H++ CO32–
2H++ CO32–
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com