
【题目】铁元素是最重要的金属元素之一,其不仅是各种钢材的主要成分,很多含铁化合物也具有重要意义。
(1)按照电子排布,可把元素周期表中的元素划分成五个区,铁元素属于_________区。
(2)Mn2+在水溶液中难被氧化,而Fe2+则易被氧化为Fe3+ ,请从离子的价电子式角度解释Mn2+与Fe2+还原能力的差别:_________。Mn2+的半径_________ Fe3+的半径(填“>”、“<”或“=”)。
(3)金属铁晶体中铁原子采用体心立方堆积,该铁晶体的空间利用率为_________(用含π的式子表示)。
(4)向含Fe3+的溶液中滴加少量的KSCN溶液,溶液中生成红色的[Fe(SCN)(H2O)5]2+。N、H、O三种元素的电负性由大到小的顺序为_________;[Fe(SCN)(H2O)5]2+中Fe3+的配位数为_________,H2O中氧原子的杂化方式为_________。
(5)二茂铁是一种含铁的有机化合物,其化学式为Fe(C5H5)2,可看作是Fe2+离子与两个正五边形的环戊二烯负离子(C5H![]() )配体形成的夹心型分子(如下图a所示)。已知大π键可用符号Π
)配体形成的夹心型分子(如下图a所示)。已知大π键可用符号Π![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π),则C5H
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π),则C5H![]() 的大π键表示为________。二茂铁是黄色针状晶体,熔点173 ℃(在100 ℃时开始升华),沸点249 ℃,在水中难溶,但可溶于很多有机溶剂。下列相互作用中,二茂铁晶体中不存在的是________(填标号)。
的大π键表示为________。二茂铁是黄色针状晶体,熔点173 ℃(在100 ℃时开始升华),沸点249 ℃,在水中难溶,但可溶于很多有机溶剂。下列相互作用中,二茂铁晶体中不存在的是________(填标号)。
A 离子键 B 配位键 C σ 键 D 范德华力

(6)一种含有Fe、Cu、S三种元素的矿物的晶胞(如上图b所示),属于四方晶系(晶胞底面为正方形),晶胞中S原子位于内部,Fe原子位于体心和晶胞表面,Cu原子位于晶胞表面。此矿物的化学式为_________。若晶胞的底面边长为A pm,高为C pm,阿伏伽德罗常数为NA,则该晶体的密度为__________ g/cm3(写出表达式)。
【答案】d Mn2+为3d5构型,d亚层半满,失去电子则需破坏此稳定结构,Fe2+为3d6,易失去1个电子成为稳定的3d5构型 > ![]() O>N>H 6 sp3
O>N>H 6 sp3 ![]() A FeCuS2(或CuFeS2)
A FeCuS2(或CuFeS2) ![]() (或
(或![]() )
)
【解析】
(1)铁元素位于元素周期表VIII族,属于d区元素;
(2)Mn2+为3d5构型,d亚层半满,失去电子则需破坏此稳定结构,Fe2+为3d6,易失去1个电子成为稳定的3d5构型,因此Mn2+在水溶液中难被氧化,而Fe2+则易被氧化为Fe3+;Mn2+与Fe3+核外电子数相同,质子数多的半径小,故半径Mn2+>Fe3+;
(3)设晶胞中铁原子半径为r,则晶胞边长为a=![]() ,则1个体心立方堆积的晶胞体积为
,则1个体心立方堆积的晶胞体积为![]() ,晶胞内共有
,晶胞内共有![]() 个原子,原子总体积为:
个原子,原子总体积为:![]() ,则其空间利用率为:
,则其空间利用率为: ;
;
(4)N、O处于同一周期,从左至右电负性逐渐增加,H元素在非金属元素中电负性最小,故电负性大小关系为:O>N>H;SCN-、H2O均为配体,因此[Fe(SCN)(H2O)5]2+中Fe3+的配位数为6;H2O中O的价层电子对数为![]() ,故氧原子的杂化方式为sp3;
,故氧原子的杂化方式为sp3;
(5)由![]() 结构可知,每个碳原子中还有1个电子未参与成键,5个碳原子以及一个
结构可知,每个碳原子中还有1个电子未参与成键,5个碳原子以及一个![]() 得到一个电子,共有6个电子参与形成大π键,因此
得到一个电子,共有6个电子参与形成大π键,因此![]() 中大π键表示为
中大π键表示为![]() ;由二茂铁的熔点低以及易升华特点可知二茂铁为分子化合物,因此二茂铁晶体中不存在离子键;
;由二茂铁的熔点低以及易升华特点可知二茂铁为分子化合物,因此二茂铁晶体中不存在离子键;
(6)根据均摊法可知,1个晶胞中含Cu原子数为:![]() ,Fe原子数为:
,Fe原子数为:![]() ,S原子数为:8,故此矿物的化学式为:FeCuS2(或CuFeS2);晶胞密度
,S原子数为:8,故此矿物的化学式为:FeCuS2(或CuFeS2);晶胞密度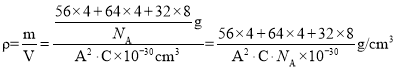 或
或![]() 。
。


科目:高中化学 来源: 题型:
【题目】两个体积相同的密闭容器A、B,在A中充入SO2和O2各1mol,在B中充入SO2和O2各2mol,加热到相同温度,有如下反应2SO2(g)+O2(g)![]() 2SO3(g),对此反应,下述不正确的是
2SO3(g),对此反应,下述不正确的是
A. 反应速率B>A B. SO2的转化率B>A
C. 平衡时各组分含量B=A D. 平衡时容器的压强B>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定压强下,向10 L密闭容器中充入1 mol S2Cl2和1 mol Cl2,发生反应S2Cl2(g)+Cl2(g) ![]() 2SCl2(g)。Cl2与SCl2的消耗速率(v)与温度(T)的关系如图所示,以下说法中不正确的是( )
2SCl2(g)。Cl2与SCl2的消耗速率(v)与温度(T)的关系如图所示,以下说法中不正确的是( )
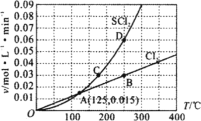
A.正反应的活化能大于逆反应的活化能
B.达到平衡后再加热,平衡向逆反应方向移动
C.A、B、C、D四点对应状态下,达到平衡状态的为B、D
D.一定温度下,在恒容密闭容器中,达到平衡后缩小容器体积,重新达到平衡后,Cl2的平衡转化率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组设计如图实验,欲使甲中试管先出现浑浊,下列操作一定达不到目的的是
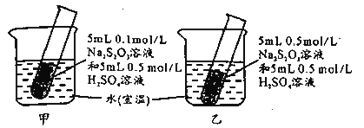
A.向甲烧杯中加入适量CaOB.向甲中试管内滴加适量浓硫酸
C.向乙烧杯中加入适量冰块D.增大甲装置所在环境的压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂-硫电池具有高能量密度、续航能力强等特点。使用新型碳材料复合型硫电极的锂-硫电池工作原理示意图如图,下列说法正确的是
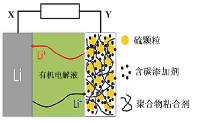
A.电池放电时,X电极发生还原反应
B.电池充电时,Y电极接电源正极
C.电池放电时,电子由锂电极经有机电解液介质流向硫电极
D.向电解液中添加Li2SO4水溶液,可增强导电性,改善性能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫酸厂产生的烧渣(主要含![]() 、
、![]() 及少量
及少量![]() )可用于制备
)可用于制备![]() 和还原铁粉,其流程如图:
和还原铁粉,其流程如图:

(1)“酸溶”前需粉碎烧渣,其目的是_________、________。
(2)“滤渣”的主要成分是_________(填化学式)。
(3)“还原”时,![]() 被氧化为
被氧化为![]() 的离子方程式是_________。
的离子方程式是_________。
(4)“焙烧”时,烧渣、无烟煤、![]() 的投料质量比为100∶40∶10,温度控制在1000℃(温度对焙烧炉气含量的影响变化如图所示):
的投料质量比为100∶40∶10,温度控制在1000℃(温度对焙烧炉气含量的影响变化如图所示):

添加![]() 的目的是:①脱除
的目的是:①脱除![]() 等;②_________。
等;②_________。
(5)“焙烧”在半封闭装置中进行,投料层表面盖有适当厚度的煤层,“焙烧”时间控制在4~4.5小时(焙烧时间对还原铁粉产率的影响如图所示),超过5小时后还原铁粉产率降低的原因是_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组在实验室进行如下实验探究活动。
(1)设计如下实验研究2Fe3++2I-![]() 2Fe2++I2的反应。
2Fe2++I2的反应。

①振荡静置后C中观察到的现象是_______________________;为证明该反应存在一定限度,还应补做实验为:取C中分液后的上层溶液,然后______________(写出实验操作和现象)。
②测定上述KI溶液的浓度,进行以下操作:
I用移液管移取20.00 mL KI溶液至锥形瓶中,加入适量稀硫酸酸化,再加入足量H2O2溶液,充分反应。
II小心加热除去过量的H2O2。
III用淀粉做指示剂,用c mol/L Na2S2O3标准溶液滴定,反应原理为:2Na2S2O3+I2=2NaI+Na2S4O6。
步骤II是否可省略?____________(答“可以”或“不可以”)
步骤III达到滴定终点的现象是___________________________。巳知I2浓度很高时,会与淀粉形成稳定的包合物不易解离,为避免引起实验误差,加指示剂的最佳时机是________。
(2)探究Mn2+对KMnO4酸性溶液与H2C2O4溶液反应速率的影响。
反应原理(化学方程式)为________;
仪器及药品:试管(两支)、0.01 mol/L KMnO4酸性溶液、0.1 mol/L H2C2O4溶液、一粒黄豆大的MnSO4固体;
实验方案:请仿照教材(或同教材)设计一个实验用表格,在行标题或列标题中注明试剂及观察或记录要点。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有铁、水、氧化钙、碳酸钙、氢氧化钠溶液、硫酸铜溶液等六种物质,从中选出适当的物质按下述要求写出一个化学方程式。
(1)化合反应________________________
(2)分解反应________________________
(3)置换反应________________________
(4)复分解反应________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如图:
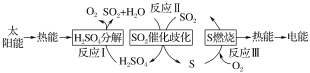
(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH=+551kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH=-297kJ·mol-1
反应Ⅱ的热化学方程式:__。
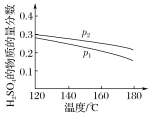
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。p2__p1(填“>”或“<”),得出该结论的理由是__。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+=S↓+2I2+2H2O
ii.I2+2H2O+__=__+__+2I-
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18mLSO2饱和溶液加入到2mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
序号 | A | B | C | D |
试剂组成 | 0.4mol·L-1KI | amol·L-1KI 0.2mol·L-1H2SO4 | 0.2mol·L-1H2SO4 | 0.2mol·L-1KI 0.0002molI2 |
实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
①B是A的对比实验,则a=__。
②比较A、B、C,可得出的结论是__。
③实验表明,SO2的歧化反应速率D>A。结合i、ii反应速率解释原因:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com