
【题目】平达喜是常用的中和胃酸的药物,它的化学成分是AlxMgy(OH)zCO3·nH2O,其中氢元素的质量分数为0.040。取该碱式盐3.01g,加入2.0mol/L盐酸使其溶解,当逐滴加入盐酸42.5mL时,开始产生CO2,加入盐酸至45.0mL时正好反应完全。若在上述碱式盐溶于盐酸后的溶液中加入过量的氢氧化钠,过滤、洗涤,沉淀物进行干燥后重1.74g。请计算该试样中:
(1)碳酸根的物质的量_____________;
(2)镁离子的物质的量_____________;
(3)通过计算确定该物质的化学组成为___________。
【答案】0.005mol 0.03mol Al2Mg6(OH)16CO3·4H2O
【解析】
⑴按照方程式HCO3- + H+ = H2O+ CO2↑计算生成二氧化碳消耗盐酸的物质的量,根据碳元素守恒得碳酸根的物质的量。
⑵生成氢氧化镁的沉淀质量为1.74g,计算氢氧化镁的物质的量,再根据守恒得镁离子的物质的量。
⑶先计算n(OH-),再根据n(OH-):n(CO32-):n(Mg2+)和根据电荷守恒求出n(OH-):n(CO32-):n(Mg2+):n(Al3+)的比例,根据碳酸根物质的量求摩尔质量求出n值。
⑴CO32- + 2H+ = H2O+ CO2↑生成二氧化碳消耗盐酸的物质的量为2.0mol/L × 0.0025L = 0.005mol;根据碳元素守恒得碳酸根的物质的量为0.005mol;故答案为:0.005mol。
⑵生成氢氧化镁的沉淀质量为1.74g,物质的量为![]() ,镁离子的物质的量为0.03mol;故答案为:0.03mol。
,镁离子的物质的量为0.03mol;故答案为:0.03mol。
⑶n(OH-) = 2.0mol/L× 0.0425L = 0.085mol,因此n(OH-):n(CO32-):n(Mg2+)=0.085mol:0.005mol:0.03mol = 16:6:1,AlxMg6(OH)16CO3·nH2O,再根据电荷守恒(+3)x+(+2)×6+(-1)×16+(-2)×1 = 0,得到x = 2,根据碳酸根物质的量求摩尔质量![]() ,27×2 + 24×6 + 17×16 + 48 + 18×n=602,n = 4;因此化学式为Al2Mg6(OH)16CO3·4H2O;故答案为Al2Mg6(OH)16CO3·4H2O。
,27×2 + 24×6 + 17×16 + 48 + 18×n=602,n = 4;因此化学式为Al2Mg6(OH)16CO3·4H2O;故答案为Al2Mg6(OH)16CO3·4H2O。


科目:高中化学 来源: 题型:
【题目】某课外活动小组在实验室用如下图所示的装置进行实验,验证氨的某些性质并收集少量纯净的N2。
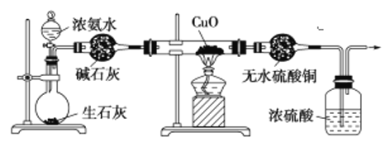
请回答:
(1)实验前先将仪器按图示连接好,然后检查装置的气密性。怎样检查该装置的气密性?________________。
(2)烧瓶内装有生石灰,随浓氨水的滴入,产生氨气。氨气产生的原因是________________。
(3)实验进行一段时间后,观察到加热的硬质玻璃管内的黑色氧化铜粉末变为红色,盛无水CuSO4的干燥管内出现蓝色,并且在最后的出气导管处收集到纯净、干燥的N2。根据这些现象,写出硬质玻璃管内发生反应的化学方程式:______________________。这个反应说明氨气具有________。
A.碱性 B.还原性 C.氧化性 D.不稳定性
(4)洗气瓶中浓硫酸的主要作用是________________________。
(5)在最后出气管的导管口收集干燥、纯净的氮气,收集方法是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某硫酸试剂瓶标签上的部分文字。据此,下列说法正确的是 ( )

A.该硫酸的物质的量浓度为9.2 mol·L-1
B.1 mol Zn与足量的该硫酸反应生成2 g氢气
C.该硫酸与等体积水混合所得溶液的物质的量浓度等于9.2 mol·L-1
D.向50 mL该硫酸溶液中加入足量的铜片,加热充分反应后,被还原的硫酸的物质的量小于0.46 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某中间体M(2—甲基丙氨酸)的结构简式如图所示。下列有关M的说法错误的是

A.分子式为![]()
B.1molM与NaOH溶液反应,消耗lmolNaOH
C.分子中所有的碳原子不可能处于同一平面
D.与M含有相同官能团的同分异构体有5种![]() 不含本身,不考虑空间异构
不含本身,不考虑空间异构![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.(1)下列右侧对左侧物质的描述与左侧任何物质都不对应的是_________(填右侧小写的编号);
物质 描述
A.四氧化三铁 a.自来水消毒剂
B.过氧化钠 b.工业制玻璃
C.碳酸氢钠 c.红色油漆和涂料
D.硅酸钠 d.木材防火剂
E.明矾 e.呼吸面具中氧气的来源
F.青铜 f.制光纤的材料
G.硅 g.用量最大的金属材料
H.氯气 h.焰色反应为绿色
II.(2)明矾溶液中加少量Ba(OH)2溶液的离子方程式 ______________;
(3)漂白粉溶液中通过量CO2的离子方程式________________;
(4)将KFe2Si3O8(OH)2改写为氧化物的形式________________,1mol KFe2Si3O8(OH)2和足量稀盐酸反应,消耗HCl的物质的量为________mol;
(5)配平下面的离子方程式,并用双线桥表示反应的电子转移:______
SO32- + MnO4- + — SO42-+ Mn2+ +______
III.(6)若要除去下列物质中的杂质(括号内为杂质),请将选用的试剂填入表格。
物质(杂质) | 试剂 |
NaHCO3溶液(Na2CO3) | ①______ |
FeCl3溶液(FeCl2) | ②______ |
SiO2(CaCO3) | ③______ |
Fe2O3(SiO2) | ④______ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】透明聚酯玻璃钢可用于制造宇航员面罩和导弹达罩。制备橐酯的一种配方中含有中基丙烯酸甲酯(MMA,结构简式如图。下列有关MMA的说法正确的是

A. MMA易溶于水和有机溶剂
B. MMA的含氧官能团是羧基
C. MMA的一种同分异构体为CH3CH2 COOCH2CH3
D. MMA能发生加成反应、水解反应、氧化反应、加聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,W是同周期主族元素中原子半径最小的,下列说法正确的是
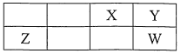
A.W位于第3周期Ⅶ族
B.原子半径![]()
C.Y的非金属性比W强,所以Y的最高价氧化物的水化物的酸性比W的强
D.X、Y、Z、W的简单氢化物中X的沸点最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)甲烷和氯气在光照条件下发生卤代反应,其反应机理如下:
反应①:![]() △H=242.7kJ·mol-1
△H=242.7kJ·mol-1
反应②:![]() △H=7.5kJ·mol-1
△H=7.5kJ·mol-1
反应③:![]() △H=-112.9kJ·mol-1
△H=-112.9kJ·mol-1
反应②、③反复循环,反应物浓度逐渐降低,自由基逐渐消失,反应停止。
(1)在该反应条件下断裂1mol CH3Cl中C—Cl键,需要吸收的能量为______。
(2)反应②与反应③的反应过程,如下图所示:
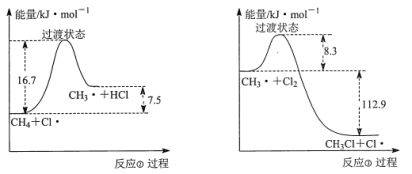
则该条件下,反应②的速率______反应③的速率(填“>”、“<”或“=”)。
(3)根据以上的反应机理,我们可以推测甲烷和氯气在光照条件下反应,除生成CH3Cl、CH2Cl2、CHCl3、CCl4外,还会有乙烷等有机物,原因是______。
(二)煤燃烧排放的SO2和NO2可形成严重的大气污染,某兴趣小组提出利用反应![]() 来处理。
来处理。
(4)在一定温度下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,达到平衡时NO2和SO2的体积之比为1:5,则该温度下平衡常数K为______。
(5)若向绝热恒容密闭容器中通入SO2和NO2,v正随时间变化如下图。下列结论正确的是______。
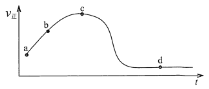
A. a点颜色比b点深
B. c点正反应速率等于逆反应速率
C. 若升高温度,d点SO2的转化率将增大
D. 反应的过程中,容器内气体压强保持不变
E. 若外界条件不发生改变,d点NO2和NO的体积比将保持不变
(6)若用一定浓度的NaClO2溶液(已调节其初始pH为5)充分吸收煤燃烧排放的烟气后,测得溶液中各物质的浓度如下表所示:

其中 NaClO2溶液吸收SO2的主要离子反应方程式为______。
(7)为消除NOx,科学家开发了一种能传导O2-的固态高温陶瓷电池,一极通氨气,另一极通NOx,生成无污染的常见气体和液体。写出该电池的正极反应式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.CH3COOCH2CH3 与 CH3CH2COOCH3 为同一种物质
B.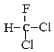 和
和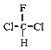 为同一物质
为同一物质
C.CH3CH2CH2CH2CH3 和 CH3CH2CH(CH3)2 互为同素异形体
D.乙醇在浓硫酸作用下迅速加热到 140℃,生成乙烯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com