
����Ŀ��ij��ѧС��Ϊ���о���������Ի�ѧ��Ӧ���ʵ�Ӱ�죬����������ʵ�飺
��ʵ�����ݼ���¼��
ʵ���� | �����£��Թ��������Լ��������� / mL | ��������Һ��ɫ������ɫ����ʱ�� / min | |||
0.6 mol/L H2C2O4��Һ | H2O | 3 mol/L ϡ���� | 0.05mol/L KMnO4��Һ | ||
1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
2 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
3 | 1.0 | 4.0 | 2.0 | 3.0 | 3.9 |
��ش�
(1)д�����Ϸ�Ӧ�Ļ�ѧ����ʽ��______________________________________________
(2)�����ϱ��е�ʵ�����ݣ����Եõ��Ľ�����______________________________________________��
(3)����ʵ��1�����ݼ��㣬����KMnO4��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ����(KMnO4) = ___________��
(4)��С��ͬѧ���ݾ��������n(Mn2+) ��ʱ��仯���Ƶ�ʾ��ͼ����ͼ1��ʾ������ͬѧ�������е�ʵ�����Ϸ��֣���ʵ�������n(Mn2+) ��ʱ��仯������Ӧ��ͼ2��ʾ����С��ͬѧ����ͼ2��ʾ��Ϣ������µļ��裬����������ʵ��̽����

�ٸ�С��ͬѧ����ļ�����____________________________________________________��
�����������С��ͬѧ���ʵ�鷽��������д���пհס�
ʵ���� | �����£��Թ��������Լ��������� / mL | �����Թ��м����������� | ��������Һ��ɫ������ɫ����ʱ�� / min | |||
0.6 mol/L | H2O | 3 mol/L ϡ���� | 0.05 mol/L KMnO4��Һ | |||
4 | 3.0 | 2.0 | 2.0 | 3.0 | _____ | t |
������С��ͬѧ����ļ��������Ӧ�۲쵽��������_____________________��
���𰸡�2KMnO4 + 5H2C2O4 + 3H2SO4 === K2SO4 + 2MnSO4 + 10CO2�� + 8H2O ����������ͬʱ������H2C2O4Ũ��(��Ӧ��Ũ��)����Ӧ�������� 0.04 mol / (L��min) �������е�MnSO4Ϊ�÷�Ӧ�Ĵ���(��Mn2+�Ը÷�Ӧ�д�����) MnSO4 ��ʵ��1�Ƚϣ���Һ��ɫ����ʱ���,������ʱ��(t)С��1.5min
��������
(1)�����ʵ��ԭ�������Ը��������������,���Ը��������ɫ���ɶ���������,�����е�C������Ϊ������̼��
(2)�ӱ������ݿ���֪���ı��������H2C2O4��Һ��Ũ��,����H2C2O4��ҺŨ�Ȳ�ͬ�Է�Ӧ���ʵ�Ӱ����н����
(3)�ȸ���H2C2O4������ص����ʵ����жϹ���,Ȼ����ݲ���������Ӧ���ʱ���ʽ�������Ӧ������
(4)����ͼ�ҿ���֪����Ӧ��ʼ��������Ũ������,��Ӧ�������ӵıȽϿ�,����̽�������������ڷ�Ӧ�е�����;
�����Ա�ʵ��ʱ�����˼��������̲�ͬ��,��������ȫ��ͬ���ݴ˽��н����
������Ӧ�ӿ���˵��������(Mn2+)�Ǵ�������Ӧ��������Һ��ɫʱ�������
(1)�����ʵ��ԭ�������Ը��������������,���Ը��������ɫ���ɶ���������,�����е�C������Ϊ������̼,��ѧ����ʽΪ:2KMnO4 + 5H2C2O4 + 3H2SO4 = K2SO4 + 2MnSO4 + 10CO2�� + 8H2O��
(2)�ӱ������ݿ���֪���ı��������H2C2O4��ҺŨ��;����������ͬʱ������H2C2O4Ũ��,��Ӧ����������
(3)��������ʵ���Ϊ:0.6mol/L��0.003L=0.0018mol��������ص����ʵ���Ϊ:0.2mol/L��0.003L=0.0006mol,���������ص����ʵ���֮��Ϊ:0.0018mol��0.0006mol=3:1,��Ȼ�������,���������ȫ��Ӧ,��Ϻ���Һ�и�����ص�Ũ��Ϊ:0.2mol/L��0.003L��(3+2+2+3)��10-3L=0.06mol/L,���ʱ����ƽ����Ӧ������(KMnO4) =0.06mol/L��1.5min=0.04mol/(L.min)��
(4)����ͼ�ҿ���֪����Ӧ��ʼ����������ıȽϿ���˵���������е�MnSO4(��Mn2+)Ϊ�÷�Ӧ�Ĵ�����
����ʵ��1���Ա�ʵ���������������̵�����ͬ����������������ͬ�����Լ������������ΪMnSO4��
������С��ͬѧ����ļ����������Ӧ���ʼӿ�����Һ��ɫ��ʱ��С��1.5min���Ӷ�˵��MnSO4(��Mn2+)Ϊ�÷�Ӧ�Ĵ�����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ��Ag2SO4��ˮ�еij����ܽ�ƽ��������ͼ��ʾ�����¶��£�����˵����ȷ����

A. ���д���SO42������Һ�п϶�������Ag��
B. Ag2SO4���ܶȻ�����(Ksp)Ϊ1��10��3
C. 0.02 mol��L��1��AgNO3��Һ��0.02 mol��L��1��Na2SO4��Һ�������ϲ������ɳ���
D. a���ʾAg2SO4�IJ�������Һ����������ʹ��Һ��a��䵽b��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������¸���˵��:
�ٽ����ͷǽ�������ʱһ���γ����Ӽ�;
�����Ӽ��������ӡ������ӵ��������;
�۸��ݵ��뷽��ʽHCl![]() H++Cl-,�ж��Ȼ��������������Ӽ�;
H++Cl-,�ж��Ȼ��������������Ӽ�;
�������������ķ�Ӧ����:H2��Cl2�����ﹲ�ۼ�������������Hԭ�ӡ�Clԭ��,����Hԭ�ӡ�Clԭ���γ����Ӽ��Ĺ���
��������˵����ȷ����
A. �٢� B. ������ȷ C. �٢ڢ� D. ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(ClO2)����������ˮ�������Դ���Ϊԭ������ClO2�Ĺ�����Ҫ�������ٴ��ξ��ƣ��ڵ������NaCl��Һ����ClO2����ȡ��������������ͼ�����з�Ӧ����ȡClO2�Ļ�ѧ����ʽΪ2NaClO3��4HCl===2ClO2����Cl2����2NaCl��2H2O��

��1���Լ�X��________(�ѧʽ)������A��������________��
��2�������������̣�д����Ӧ��Ļ�ѧ����ʽ��________________________________��
��3����ClO2������������ˮ������һ�����к���ClO2-���ҹ��涨����ˮ��ClO2-�ĺ���Ӧ������0.2 mg��L��1���ⶨˮ����ClO2��ClO2-�ĺ����Ĺ������£�
����ȡ20 mLˮ�����뵽��ƿ�У�������ˮ����pHΪ7.0��8.0��
�ڼ���������KI���塣�˹��̷�����Ӧ2ClO2��2I��=2 ClO2-��I2��
�ۼ�������������Һ������������Һ�еμ�1��10��3 mol��L��1 Na2S2O3��Һ����Һ��ɫ�պ���ȥ������Na2S2O3��Һ5.960 mL���˹��̷�����Ӧ��2S2O32-��I2=S4O62-��2I����
�ܵ�����Һ��pH��2.0���˹��̷�����ӦClO2-��4H����4I��=Cl����2I2��2H2O��
��������Һ�еμ�1��10��3 mol��L��1 Na2S2O3��Һ����ɫ�պ���ȥ������Na2S2O3��Һ24.00 mL�������������ݼ��㲢�жϸ�ˮ����ClO2-�ĺ����Ƿ����ҹ涨____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ӧ��
��Ӧ�� Fe(s)+H2O(g)![]() FeO(s)+H2(g) ��H1 ƽ�ⳣ��ΪK1
FeO(s)+H2(g) ��H1 ƽ�ⳣ��ΪK1
��Ӧ�� CO(g)+H2O(g)![]() H2(g)+CO2(g) ��H2 ƽ�ⳣ��ΪK2
H2(g)+CO2(g) ��H2 ƽ�ⳣ��ΪK2
��Ӧ�� Fe(s)+CO2 (g)![]() FeO(s)+CO(g) ��H3 ƽ�ⳣ��ΪK3
FeO(s)+CO(g) ��H3 ƽ�ⳣ��ΪK3
�ڲ�ͬ�¶��£�����K1��K2��ֵ���£�
T/�� | 700 | 800 |
K1 | 2.38 | 2.56 |
K2 | 0.80 |
(1)K1�ı���ʽΪ________�����ݷ�Ӧ�����������Ƶ���K1��K2��K3�Ĺ�ϵʽK3=______��
(2)Ҫʹ��Ӧ����һ�������½�����ƽ�����ƣ��ɲ�ȡ�Ĵ�ʩ��_________��(����ĸ)
A����С������� B�������¶� C�������¶�
D��ʹ�ú��ʵĴ��� E���跨����H2���� F���跨����FeO����
(3)800��ʱ�����ݻ�Ϊ2L�ĺ����ܱ������г���һ������CO��H2Oά�ֺ��£�������Ӧ�ڣ���Ӧ�����вⶨ�IJ������ݼ��±���
��Ӧʱ��/min | 0 | 2 | 4 | 6 |
n(CO)/mol | 1.20 | 0.90 | 0.80 | |
n(H2O)/ mol | 0.60 | 0.20 |
�ٷ�Ӧ��2 min�ڵ�ƽ������Ϊv(H2O)��________________��
��800��ʱ��K2��ֵΪ_______________��
�۱��������������䣬��ƽ����ϵ����ͨ��0.20 mol H2O����ԭƽ����ȣ��ﵽ��ƽ��ʱCOת����_______________(����������������С������������)��
(4)��������Ϣ�ƶϷ�Ӧ������Ӧ����Ϊ________(��������������������)��Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��������ƿ�ϣ������ǵ�����______��
A���̶��� B���¶� C��Ũ�� D���ݻ�
��2���ù�����Ʒ����һ�����ʵ���Ũ�ȵ���Һ���辭���������ܽ⡢ת����Һ�����ݵȲ���������ͼʾ��Ӧ�IJ����淶������______��
A������ B���ܽ�
B���ܽ�
C��ת�� D������
D������![]()
��ʵ��������500mL 0.2mol��L��1��Na2SO4��Һ��ʵ����������У�
A������ƽ�ϳƳ�14.2g�����ƹ��壬���������ձ��У�������������ˮʹ����ȫ�ܽⲢ��ȴ�����¡�
B�����Ƶõ���ҺС�ĵ�ת�Ƶ�����ƿ�С�
C������������ƿ�м�����ˮ��Һ���̶���1��2cm�������ý�ͷ�ι�С�ĵμ�����ˮ����Һ��Һ����ʹ���̶������С�
D������������ˮϴ���ձ��Ͳ�����2��3�Σ�ÿ��ϴ�ӵ�Һ�嶼С��ע������ƿ����������
E��������ƿƿ�����������ҡ�Ⱥ�װƿ��
����д���пհף�
��1�������������ȷ˳��Ϊ(�����)_____��
��2����ʵ���õ��Ļ������������ձ�����ƽ(�����롢����)������������ȱ�ٵ�������_____��____��
��3�������ƹ����У�������������ȷ�����в������������ƫ�ߵ���____��������ţ�
��δϴ���ձ���������
��δ��NaOH��Һ��ȴ�����¾�ת�Ƶ�����ƿ��
������ƿ�����������������ˮ
�ܶ���ʱ���ӿ̶���
�ݶ���ʱ���ӿ̶���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£����ڿ��淴Ӧ��X(g)��3Y(g) ![]() 2Z(g)����X��Y��Z����ʼŨ�ȷֱ�Ϊc1��c2��c3������Ϊ�㣩���ﵽƽ��ʱ��X��Y��Z��Ũ�ȷֱ�Ϊ0.1 mol��L��1��0.3 mol��L��1��0.08 mol ��L��1���������ж���ȷ���ǣ� ��
2Z(g)����X��Y��Z����ʼŨ�ȷֱ�Ϊc1��c2��c3������Ϊ�㣩���ﵽƽ��ʱ��X��Y��Z��Ũ�ȷֱ�Ϊ0.1 mol��L��1��0.3 mol��L��1��0.08 mol ��L��1���������ж���ȷ���ǣ� ��
A. c1��c2��1��3
B. ƽ��ʱY��Z����������֮��Ϊ2��3
C. X��Y��ת����֮��Ϊ1��3
D. c1��ȡֵ��ΧΪ0.04 mol��L��1��c1��0.14 mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ���� ( )
A. FeCl3��Һ��Fe(OH)3������Fe(OH)3�����ı�����������û�ж����ЧӦ
B. ���ݷ�ɢϵ���ȶ��Դ�С��������Ϊ���塢��Һ����Һ
C. ���������ͼ���װ��10mLˮ���Թ��У��������γɽ���
D. ���塢��ɢϵ�����������Ĵ�����ϵ����ͼ��ʾ

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ�������ͼ��ʾ��ʵ��װ�ã����������볱ʪ����ʯ�ҷ�Ӧ��ȡ����Ư��(����һ�����ȷ�Ӧ)����ش��������⣺
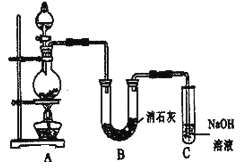
��1��A��B�еķ�Ӧ��ֱ���Ũ�����MnO2��д���������Ļ�ѧ����ʽ__________������װ��C������������������_____��_____��
��2��Ư�۵���Ч�ɷ���____���ѧʽ����D���������Ļ�ѧ��Ӧ�����ӷ���ʽ��_______��
��3����ʵ������Ư�۵�Ca(ClO)2����ƫ�͡���ѧ�����������������Ϸ��֣���Ҫԭ������U�ι��л�������������Ӧ�� ���¶Ƚϸ�ʱ��������ʯ�ҷ�Ӧ����Ca(ClO3)2��Ϊ����˸���Ӧ�ķ������ɲ�ȡ�Ĵ�ʩ��__����Ϊ������һ����Ӧ�ķ�����Ӧ��ȡ�Ĵ�ʩ��________��
��4��������ʵ���в�����Cl2������ͨ��KI��Һ������������Һ�ȱ�ƺ����ɫ���ҿɼ�HIO3��д������ƽ��������ɫ����Ӧ�Ļ�ѧ����ʽ��________������KI��ΪKBr��Һ������Һ��Ϊ__ɫ��δ��HBrO3�Ĵ��ڡ���������ʵ�Ʋ⣬Cl2��HIO3��HBrO3����������ǿ�����Ĵ�����______��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com