
ЁОЬтФПЁПЛЏбЇгУгяЪЧбЇЯАЛЏбЇЕФживЊЙЄОпЃЌЧыдЫгУЫљбЇжЊЪЖЛиД№ЯТСаЮЪЬтЃК
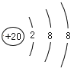
ЃЈ1ЃЉаДГіБэЪОКЌга8ИіжЪзгЁЂ10ИіжазгЕФдзгЕФЛЏбЇЗћКХ________ЁЃ
ЃЈ2ЃЉЧыаДГіЯТСаЮяжЪЕФЕчзгЪНЁЃ
CO2________ЁЃ Na2O2________ЁЃ
ЃЈ3ЃЉЧыгУЕчзгЪНБэЪОNaClЕФаЮГЩЙ§ГЬ___________ЁЃ
ЃЈ4ЃЉЧыаДГіЕк4жмЦкЂђAдЊЫиЖдгІЕФРызгНсЙЙЪОвтЭМ_____ЁЃ
ЃЈ5ЃЉЮвУЧбЇЙ§аэЖржУЛЛЗДгІЁЃжУЛЛЗДгІЕФЭЈЪНПЩвдБэЪОЮЊЃКЕЅжЪЃЈAЃЉЃЋЛЏКЯЮяЃЈBЃЉЃНЛЏКЯЮяЃЈAЃЉЃЋЕЅжЪЃЈBЃЉЁЃЧыаДГіТњзувдЯТвЊЧѓЕФ3ИіжУЛЛЗДгІЕФЛЏбЇЗНГЬЪНЁЃЂйЫљЩцМАЕФдЊЫиОљЮЊЖЬжмЦкЃЛЂк6жжЕЅжЪЗжЪє6ИіВЛЭЌЕФжїзхЁЃ______
ЁОД№АИЁП![]() O
O ![]()
![]()
![]()
 2Mg+CO2
2Mg+CO2 2MgO+CЃЌ2Al+6HCl=2AlCl3+3H2ЁќЃЌ2F2+2H2O=4HF+O2
2MgO+CЃЌ2Al+6HCl=2AlCl3+3H2ЁќЃЌ2F2+2H2O=4HF+O2
ЁОНтЮіЁП
(1)КЌга8ИіжЪзгЁЂ10ИіжазгЕФдзгЦфжЪСПЪ§=жЪзгЪ§+жазгЪ§=10+8=18ЃЌжЪзгЪ§ЮЊ8дђЮЊбѕдЊЫиЃЌЛЏбЇЗћКХЮЊ![]() OЃЛ
OЃЛ
(2)CO2ЮЊЙВМлЛЏКЯЮяЃЌУПИіOдзггыЬМдзгЙВгУСНЖдЕчзгЃЌЕчзгЪНЮЊ![]() ЃЛNa2O2ЮЊРызгЛЏКЯЮяЃЌЦфЕчзгЪНЮЊ
ЃЛNa2O2ЮЊРызгЛЏКЯЮяЃЌЦфЕчзгЪНЮЊ![]() ЃЛ
ЃЛ
(3)ТШдзгЕУЕНвЛИіЕчзгаЮГЩТШРызгЃЌФЦдзгЪЇШЅвЛИіЕчзгаЮГЩФЦРызгЃЌФЦРызггыТШРызгаЮГЩТШЛЏФЦЃЌаЮГЩЙ§ГЬЮЊ![]() ЃЛ
ЃЛ
(4)Ек4жмЦкЂђAдЊЫиЮЊ20КХдЊЫиCaЃЌЪЇШЅСНИіЕчзгЩњГЩИЦРызгЃЌРызгНсЙЙЪОвтЭМЮЊ ЃЛ
ЃЛ
(5)ИљОнжУЛЛЗДгІЕФЬиЕувдМАВЮМгЗДгІЕФдЊЫиЕФвЊЧѓЃЌНсКЯжУЛЛЗДгІЕФИХФюЃЌЕУГіЗћКЯЬѕМўЕФЗДгІПЩвдЪЧЃК2Mg+CO2 2MgO+CЃЌ2Al+6HCl=2AlCl3+3H2ЁќЃЌ2F2+2H2O=4HF+O2ЁЃ
2MgO+CЃЌ2Al+6HCl=2AlCl3+3H2ЁќЃЌ2F2+2H2O=4HF+O2ЁЃ


 зжДЪОфЦЊгыЭЌВНзїЮФДяБъЯЕСаД№АИ
зжДЪОфЦЊгыЭЌВНзїЮФДяБъЯЕСаД№АИ зпНјЮФбдЮФЯЕСаД№АИ
зпНјЮФбдЮФЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЛЏКЯЮяМзжЛКЌCЁЂHСНжждЊЫиЃЌЛЏКЯЮяввКЭБћЖМжЛКЌCЁЂHЁЂFШ§жждЊЫиЃЌМзЁЂввЁЂБћЖМЪЧБЅКЭЛЏКЯЮяЧвЗжзгжаЖМКЌга26ИіЕчзгЁЃОнДЫЭЦЖЯЃК
(1)МзЕФЗжзгЪНЪЧ________ЃЛШєМзЗжзгжагаСНИіHдзгБЛFдзгДњЬцЃЌЫљЕУВњЮяПЩФмга________жжНсЙЙЁЃ
(2)ввЪЧадФмгХвьЕФЛЗБЃВњЦЗЃЌЫќПЩЬцДњФГаЉЛсЦЦЛЕГєбѕВуЕФЗњРяАКВњЦЗЃЌгУзїжЦРфМСЁЃвбжЊввЗжзгжаCЁЂHЁЂFдзгИіЪ§БШЮЊ1ЃК2ЃК2ЃЌдђввЕФЕчзгЪНЪЧ________ЃЛЯТСаЖдгкввЕФУшЪіе§ШЗЕФЪЧ________ЁЃ
AЃЎЦфЗжзгЙЙаЭЮЊе§ЫФУцЬх BЃЎЦфЗжзгЙЙаЭЮЊе§ЫФБпаЮ
CЃЎОпгаСНжжЭЌЗжвьЙЙЬх DЃЎУЛгаЭЌЗжвьЙЙЬх
(3)НЋМзЁЂввАДЮяжЪЕФСПжЎБШ1ЃК1ЛьКЯЫљЕУЛьКЯЮяЕФЦНОљФІЖћжЪСПЕШгкБћЕФФІЖћжЪСПЃЌдђБћЕФЗжзгЪНЪЧ________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПаДГіЯТСаЗДгІЕФЛЏбЇЗНГЬЪНЛђРызгЗНГЬЪН
ЃЈ1ЃЉЙ§бѕЛЏФЦгыЖўбѕЛЏЬМЗДгІЕФЛЏбЇЗНГЬЪНЃК_______________________________ЁЃ
ЃЈ2ЃЉЬњгыЫЎеєЦјЕФЗДгІЕФЛЏбЇЗНГЬЪН:___________________________________ЁЃ
ЃЈ3ЃЉЬМЫсФЦШмвКгыбЮЫсЗДгІРызгЗНГЬЪН:___________________ЁЃ
ЃЈ4ЃЉЬМЫсЧтФЦШмвКгыЧтбѕЛЏФЦШмвКЗДгІРызгЗНГЬЪН_____________________ЁЃ
ЃЈ5ЃЉбѕЛЏТСгыЧтбѕЛЏФЦШмвКЗДгІРызгЗНГЬЪНЃК__________________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГгаЛњЮягЩCЁЂHЁЂOШ§жждЊЫизщГЩЁЃШЁ8.88gбљЦЗдкШчЯТзАжУжагУЕчТЏМгШШГфЗжШМЩеЃЌЭЈЙ§ВтЖЈЩњГЩЕФCO2КЭH2OЕФжЪСПЃЌдйНшжњжЪЦзЭМШЗЖЈЦфЗжзгЪНЁЃ
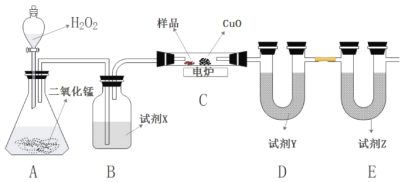
ЧыЛиД№ЯТСаЮЪЬтЃК
(1)BзАжУжаЪдМСXЮЊ____________ЁЃ
(2)DзАжУжаЪдМСYЮЊ_______ЃЈЬюЁАЮоЫЎТШЛЏИЦЁБЛђЁАМюЪЏЛвЁБЯТЭЌЃЉЃЌEзАжУжаЪдМСZЮЊ_________ЁЃ
(3)ШчЙћCзАжУжаУЛгаCuOЃЌМюЪЏЛвзАжУЕФдіжиНЋ____________ЃЈЬюЁАдіДѓЁБЁАМѕЁБЛђЁАВЛБфЁБЯТЭЌЃЉЁЃ
(4)ЪЕбщВтЕУЮоЫЎТШЛЏИЦзАжУдіжи10.8gЃЛМюЪЏЛвбbжУдіжи21.12gЃЌгЩжЪЦзвЧВтЕУИУгаЛњЮяЕФЯрЖдЗжзгСПЮЊ74ЃЌдђИУгаЛњЮяЕФЗжзгЪНЮЊ___ЁЃ
(5)ИУгаЛњЮяКьЭтЙтЦзЭМЩЯгаєЧЛљЕФЧПЮќЪеЗхЃЌЪдаДГіИУгаЛњЮяПЩФмЕФНсЙЙМђЪН________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПИпТЏСЖЬњжаЗЂЩњЕФЛљБОЗДгІжЎвЛШчЯТЃКFeO(s)+CO(g)![]() Fe(s)+CO2(g) ЁїHЃО0ЃЌЦфЦНКтГЃЪ§БэДяЪНЮЊK=__ЃЌгжжЊ1100ЁцЪБЃЌK=0.28ЁЃ
Fe(s)+CO2(g) ЁїHЃО0ЃЌЦфЦНКтГЃЪ§БэДяЪНЮЊK=__ЃЌгжжЊ1100ЁцЪБЃЌK=0.28ЁЃ
ЃЈ1ЃЉЮТЖШЩ§ИпЃЌЛЏбЇЦНКтвЦЖЏКѓДяЕНаТЕФЦНКтЃЌЦНКтГЃЪ§__ЃЈЬюЁАБфДѓЁБЁЂЁАБфаЁЁБЛђЁАВЛБфЁБЃЉЁЃ
ЃЈ2ЃЉ1100ЁцЪБВтЕУИпТЏжаc(CO2)=0.013mol/LЃЌc(CO)=0.05mol/LЃЌдкетжжЧщПіЯТЃЌИУЗДгІЪЧЗёДІгкЛЏбЇЦНКтзДЬЌЃК__ЃЈЬюЁАЪЧЁБЛђЁАЗёЁБЃЉЃЌДЫЪБЃЌЛЏбЇЗДгІЫйТЪЪЧvе§__vФцЃЈЬюЁАДѓгкЁБЁЂЁАаЁгкЁБЛђЁАЕШгкЁБЃЉЃЌЦфдвђ__ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЩшNaЮЊАЂЗќМгЕТТоГЃЪ§ЕФжЕЁЃвбжЊЗДгІЃК
ЂйCH4 (g) +2O2 (g) = CO2 (g) +2H2O(l) ЁїH1 =a kJ mol -1
ЂкCH4(g) + 2O2 (g) = CO2 (g) +2H2O(g) ЁїH2 =bkJ mol-1
МќФмЖЈвхЃКдкБъзМзДПіЯТЃЌНЋ1 molЦјЬЌЗжзгAB(g)НтРыЮЊЦјЬЌдзг
A(g)ЁЂB(g)ЫљашЕФФмСПЁЃвбжЊ1 molбѕЦјЕФМќФмЮЊxkJЁЃЦфЫћЪ§ОнШчЯТ БэЫљЪОЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ
ЛЏбЇМќ | CЁЊO | CЁЊH | OЁЊH |
МќФм/(kJ mol-1) | 798 | 413 | 463 |
A.ЩЯЮФжаx=![]()
B.H2O(g) = H2O(1)ЕФЁїS<0ЁЂЁїH=(a ЁЊ b) kJ mol -1
C.ЕБга4NAИіOЁЊHМќЩњГЩЪБЃЌЗДгІЗХГіЕФШШСПЮЊa kJ
D.РћгУЗДгІЂйЩшМЦЕФдЕчГиЕчНтОЋСЖЭЃЌЕБИКМЋЪфГі0.2NAИіЕчзгЪБ. РэТлЩЯЕчНтВлЕФвѕМЋжЪСПдіжи6.4 g
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЫЕЗЈе§ШЗЕФЪЧ![]()
A.ТѓбПЬЧгыесЬЧЕФЫЎНтВњЮяОљКЌЦЯЬбЬЧЃЌЙЪЖўепОљЮЊЛЙдаЭЖўЬЧ
B.ЪвЮТЯТЃЌНЋ![]() HAШмвККЭ
HAШмвККЭ![]() ШмвКЕШЬхЛ§ЛьКЯ
ШмвКЕШЬхЛ§ЛьКЯ![]() КіТдЬхЛ§ЕФБфЛЏ
КіТдЬхЛ§ЕФБфЛЏ![]() ВтЕУЛьКЯШмвКЕФ
ВтЕУЛьКЯШмвКЕФ![]() ЃЌдђЛьКЯШмвКжагЩЫЎЕчРыГіЕФ
ЃЌдђЛьКЯШмвКжагЩЫЎЕчРыГіЕФ![]()
C.ДПЬМаТВФСЯЁАЬМФЩУзХнФЁБЃЌУПИіХнФКЌгадМ4000ИіЬМдзгЃЌжБОЖдМ6ЕН9nmЃЌдкЕЭгк![]() ЪБЃЌХнФОпгагРОУДХадЃЌЁАЬМФЩУзХнФЁБгыЪЏФЋЛЅЮЊЭЌЫивьаЮЬх
ЪБЃЌХнФОпгагРОУДХадЃЌЁАЬМФЩУзХнФЁБгыЪЏФЋЛЅЮЊЭЌЫивьаЮЬх
D.вбжЊ![]() ЕФ
ЕФ![]() ЮЊ
ЮЊ![]() ЃЌдђНЋЕШЬхЛ§ЕФ
ЃЌдђНЋЕШЬхЛ§ЕФ![]()
![]() ЕФ
ЕФ![]() ШмвККЭ
ШмвККЭ![]()
![]()
![]() ШмвКЛьКЯКѓЛсга
ШмвКЛьКЯКѓЛсга![]() ГСЕэВњЩњ
ГСЕэВњЩњ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЕБгУЫсЕЮЖЈМюЪБЃЌЯТСаВйзїжаЛсЪЙВтЖЈНсЙћЃЈМюЕФХЈЖШЃЉЦЋЕЭЕФЪЧ
A.ЫсЪНЕЮЖЈЙмЕЮжСжеЕуКѓЃЌИЉЪгЖСЪ§
B.МювКвЦШызЖаЮЦПКѓЃЌМгСЫ10 mLеєСѓЫЎдйЕЮЖЈ
C.ЫсЪНЕЮЖЈЙмгУеєСѓЫЎШѓЯДКѓЃЌЮДгУБъзМвКШѓЯД
D.ЫсЪНЕЮЖЈЙмзЂШыЫсвККѓЃЌМтзьСєгаЦјХнМДПЊЪМЕЮЖЈЃЌЕЮЖЈжеЕуЪБЦјХнЯћЪЇ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПИљОнЯТСаЭМЪОЫљЕУГіЕФНсТлВЛе§ШЗЕФЪЧ

A. ЭММзЪЧCO(g)+H2O(g)![]() CO2(g)+H2(g)ЕФЦНКтГЃЪ§гыЗДгІЮТЖШЕФЙиЯЕЧњЯпЃЌЫЕУїИУЗДгІЕФІЄH<0
CO2(g)+H2(g)ЕФЦНКтГЃЪ§гыЗДгІЮТЖШЕФЙиЯЕЧњЯпЃЌЫЕУїИУЗДгІЕФІЄH<0
B. ЭМввЪЧЪвЮТЯТH2O2ДпЛЏЗжНтЗХГібѕЦјЕФЗДгІжаc(H2O2 )ЫцЗДгІЪБМфБфЛЏЕФЧњЯпЃЌЫЕУїЫцзХЗДгІЕФНјааH2O2ЗжНтЫйТЪж№НЅМѕаЁ
C. ЭМБћЪЧЪвЮТЯТгУ0.1000 molЁЄL1NaOHШмвКЕЮЖЈ20.00 mL 0.1000 molЁЄL1ФГвЛдЊЫсHXЕФЕЮЖЈЧњЯпЃЌЫЕУїHXЪЧвЛдЊЧПЫс
D. ЭМЖЁЪЧЪвЮТЯТгУNa2SO4Г§ШЅШмвКжаBa2+ДяЕНГСЕэШмНтЦНКтЪБЃЌШмвКжаc(Ba2+ )гыc(SO42)ЕФЙиЯЕЧњЯпЃЌЫЕУїШмвКжаc(SO42 )дНДѓc(Ba2+ )дНаЁ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com