
【题目】化学中有许多的“守恒相等”,下列不符合的是( )
A.化学反应中,反应物总能量与生成物总能量
B.化学反应中,反应物总质量与生成物总质量
C.溶液中,稀释前溶质质量与稀释后溶质质量
D.在化合物中,正化合价总数与负化合价总数
科目:高中化学 来源: 题型:
【题目】聚对苯二甲酸乙二酯(J)具有良好的力学性能,其薄膜的伸拉强度是聚乙烯薄膜的9倍。它的合成路线如下:
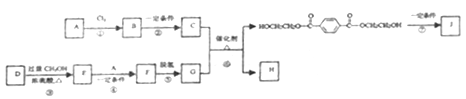
已知:
①![]()
②酯与醇可发生如下酯交换反应:RCOOR′+R〞OH ![]() RCOOR〞+R′OH(R、R′、R〞代表烃基)
RCOOR〞+R′OH(R、R′、R〞代表烃基)
(1)A的产量标志着一个国家石油化工发展水平,反应①的反应类型为______________。
(2)C的分子式是C2H6O2,是汽车防冻液的主要成分。反应②的试剂和反应条件是____________。
(3)D的分子式是C6H6O4,是一种直链结构的分子,核磁共振氢谱有3种峰,D种含有的官能团是______。
(4)F的结构简式是__________________。
(5)反应⑥的化学方程式是_________________。
(6)反应⑦为缩聚反应,反应⑦的化学方程式是_________________。
(7)G是一种同分异构体,G′为甲酸酯,核磁共振氢谱有3种峰且1mol该有机物酸性条件下水解产物能与2molNaOH反应。G′的结构简式为______________。
(8)以对二甲苯、甲醇为起始原料,选用必要的无机试剂合成G,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某单烯烃A(C8H16)可以发生如下图示的转化,回答下列问题

已知: ![]()

(1)B的分子式为____________,D中含有官能团的名称______________。
(2)B无银镜反应,D在浓硫酸存在下加热可得到能使溴水褪色且只有一种结构的物质E(不考虑立体异构),请写出E的结构简式____________________,D→E的反应类型_______________。
(3)写出C→F的化学方程式_________________。
(4)H的同分异构体中,满足下列要求的结构一共有____________种(不考虑立体异构,包括H本身)
①属于酯类;②酸性条件下水解能得到相对分子质量为74的有机物
(5)已知:
请写出由C制备2-丙醇的合成路线____________(无机原料任选)。合成路线流程图示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、(1)分子中有6个甲基,而一溴代物只有1种的烷烃,结构简式是________。
(2)烯烃与溴化氢、水加成时,产物有主次之分,例如:
![]()
A是一种不对称烯烃,与HBr加成时,生成的主要产物为B,与水加成时,生成的主要产物为C,
且B中仅含有4个碳原子、1个溴原子、1种氢原子,则B的结构简式为:_________。
A与水在催化剂存在下发生加成反应的化学方程式___________________。(只写主要产物)。
Ⅱ、卤代烃在碱性醇溶液中能发生消去反应。下面是六个有机化合物的转换关系。请回答下列问题:
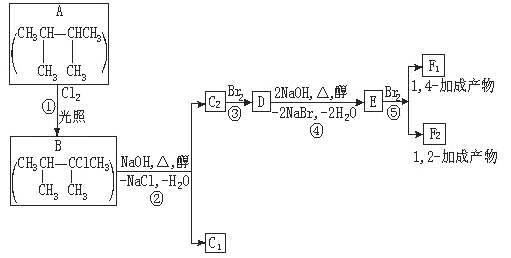
(1)上述框图中,①是___________反应。
(2)化合物E是重要的工业原料,写出由D生成E的化学方程式____________。
(3)C1的结构简式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有Fe3+、Fe2+、Al3+、NH的稀溶液中加入足量Na2O2固体,充分反应后,再
加入过量稀盐酸,完全反应,则离子数目没有变化的是( )
A.Fe3+、Al3+ B.Al3+ C.Fe2+、NH D.Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下图所示装置,用电解法把Na2CrO4溶液转变为Na2Cr2O7溶液(2CrO42-+2H+=Cr2O72-+H2O)。下列说法正确的是
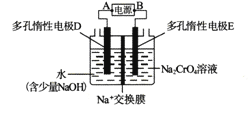
A. A为正极,B为负极
B. 电解过程中,电解槽左侧溶液pH增大
C. 电解过程中,Na+在电解槽中自左向右迁移
D. 当电路中通过lmol电子时,阴极生成0.5mol Na2Cr2O7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三草酸合铁(Ⅲ)酸钾是制备负载活性催化剂的主要原料。加热至110℃时失去结晶水,230℃时分解。极易感光,室温下光照变为黄色:
2K3[Fe(C2O4)3]·3H2O![]() 2FeC2O4·2H2O+3K2C2O4+2CO2↑+2H2O
2FeC2O4·2H2O+3K2C2O4+2CO2↑+2H2O
已知:
物质名称 | 化学式 | 相对分子质量 | 颜色 | 溶解性 |
三草酸合铁(Ⅲ)酸钾 | K3[Fe(C2O4)3]·3H2O | 491 | 翠绿色 | 可溶于水,难溶于乙醇 |
草酸亚铁 | FeC2O4·2H2O | 180 | 黄色 | 难溶于水,可溶于酸 |
某同学对三草酸合铁(Ⅲ)酸钾的制备及组成进行了实验探究。回答下列问题:
(一)三草酸合铁(Ⅲ)酸钾的制备
(ⅰ)称取4.50 g FeC2O4·2H2O固体,加入饱和K2C2O4溶液中,用滴管慢慢加入3% H2O2溶液,不断搅拌,并保持温度在40℃左右。充分反应后,沉淀转化为氧氧化铁。
(ⅱ)加热至沸腾,滴加1mol 的草酸溶液至沉淀溶解。用草酸或草酸钾调节溶液pH=4-5
(ⅲ)小火加热浓缩,冷却结晶,过滤,先用少量冰水洗涤,再用无水乙醇洗涤,低温干燥后称量,得到9.80g 翠绿色晶体。
(1)完成步骤(i)发生反应的离子方程式:
____FeC2O4·2H2O+______C2O42-+____H2O2=___Fe(OH)3+4[Fe(C2O4)3]3-+____H2O
(2)步骤(ⅲ)中,用无水乙醇洗涤晶体的目的是________。
(3)列式计算本实验中三草酸合铁(Ⅲ)酸钾的产率______________。
(二)草酸根含量侧定
准确称取4.80g 三草酸合铁(Ⅲ)酸钾样品,配制成250mL 溶液。量取25.00 mL 溶液置于锥形瓶中,加入5.0 mL 1mol/L H2SO4,用0.06mol/L的KMnO4 溶液滴定。滴定终点时消耗KMnO4溶液20.00mL。
(4)滴定过程中,盛放高锰酸钾溶液的仪器名称是_______________,滴定时发生反应的离子方程式为_____。
(5)样品中草酸根的物质的量为_______;若该数值大于4.80g二草酸合铁(Ⅲ)酸钾纯品中草酸根的物质的量,其原因可能是_______(填字母)。
a.制取过程中草酸或草酸钾用量过多
b.样品未完全干燥
c.滴定时盛放KMnO4溶液的仪器未用标准液润洗
d.锥形瓶洗净后未烘干
(三)某同学制得的三草酸合铁(Ⅲ)酸钾,晶体表面发黄,推测可能有部分晶体发生了分解。
(6)为了验证此推测是否正确,可选用的试剂是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能够成功的是( )
A. 只用溴水一种试剂可鉴别甲苯、己烯、乙醇、四氯化碳四种物质
B. 将乙醇加热到170 ℃可制得乙烯
C. 将乙醇、冰醋酸及pH=0的硫酸共同加热可制乙酸乙酯
D. 用酚酞可鉴别苯酚钠和乙醇钠两种溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com