
【题目】氢化钠(NaH)是一种白色的离子化合物,其中钠显+1 价,NaH 与水反应放出氢气。下列叙述正确的是( )
A. NaH 在水中显酸性 B. 钠与其他碱金属都必须保存在煤油中
C. NaH 中氢离子半径比锂离子半径大 D. NaH 中氢离子被还原为氢气
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列有关化学用语的表示方法中正确的是
A. ![]()
B. M2+离子核外有a个电子,b个中子,M原子符号为![]()
C. 用电子式表示MgCl2的形成过程为![]()
D. 次氯酸的电子式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.实验室应将钠保存在煤油中B.分液漏斗和容量瓶在使用前都要检漏
C.液氯不可以储存在钢瓶中D.金属钠失火不可用水来灭火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小 b极质量增加 | b极有气体产生 c极无变化 | d极溶解 c极有气体产生 | 电流计指示在导线中 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是
A a>b>c>d B b>c>d>a C d>a>b>c D a>b>d>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学小组采用类似制乙酸乙酯的装置(如图),用环己醇制备环己烯。
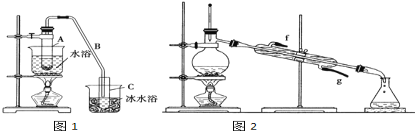
已知:
相对分子质量 | 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 100 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 82 | 0.81 | -103 | 83 | 难溶于水 |
(1)制备粗品:
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片(防止暴沸),缓慢加热至反应完全,在试管C内得到环己烯粗品。
①导管B除了导气外还具有的作用是_________.
②试管C置于冰水浴中的目的是____________________________.
(2)制备精品:
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静止、分层,环己烯在______层(填“上”或“下”),分液后用_______(填选项字母)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按如图2装置蒸馏,蒸馏时要加入生石灰,目的是__________________________.
③蒸馏收集产品时,实验制得的环己烯精品质量低于理论产量,可能的原因是_______(填选项字母).
a. 蒸馏时从70℃开始收集产品 b. 环己醇实际用量多了
c. 制备粗品时环己醇随产品一起蒸出。
(3)以下区分环己烯精品和粗品的方法,合理的是_______(填选项字母)。
a. 分别加入用金属钠 b. 分别加入酸性高锰酸钾溶液
c. 分别测定沸点 d. 分别加入FeCl3溶液
(4)如果最终得到纯净环己烯产品质量为8.2 g, 则该实验所得到的环己烯产率是___________(保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将30 mL 0.5 mol·L-1 NaOH溶液加水稀释到500 mL,关于稀释后的溶液叙述不正确的是( )
A. 浓度为0.03 mol·L-1 B. 从中取出10 mL溶液,其浓度为0.03 mol·L-1
C. 含NaOH 0.6 g D. 从中取出10 mL溶液,含NaOH 0.015 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质。下面给出13种元素的X的数值:
元素 | Al | B | Be | C | Cl | F | Li |
X的数值 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
元素 | Mg | Na | O | P | S | Si | |
X的数值 | 1.2 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
试结合元素周期律知识完成下列问题:
(1)请预测K与Rb元素的X数值的大小关系:K ______ Rb (填“>”、“=”或“<”)。
(2)经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键,试推断AlBr3中的化学键类型是____。
(3)某有机化合物分子中含有S-N键,你认为该共用电子对偏向于____原子(填元素符号).
(4)简述第二周期元素(除稀有气体外)的X的数值大小与原子半径之间的关系:________。
Ⅱ.(1)
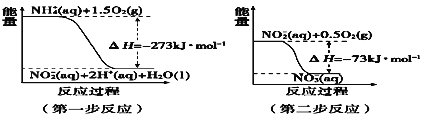
①第一步反应是____反应(选填“放热”或“吸热”),判断依据_____。
②1 molNH4+(aq)全部氧化成NO3- (aq)的热化学方程式_______。
(2)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储,过程如下:
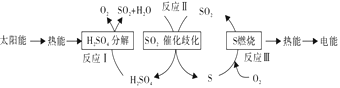
反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ/mol
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=297 kJ/mol
反应Ⅱ的热化学方程式:_______________。
(3)一定条件下,不同量的CO2与不同量的NaOH充分反应放出的热量如下表所示:
CO2的量 | NaOH的量 | 放出的热量 |
22.0 g | 750 mL 1.0 mol/L | x kJ |
1.0 mol | 2.0 L 1.0 mol/L | y kJ |
写出该条件下,CO2与NaOH反应生成NaHCO3的热化学方__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某儿童微量元素体检报告单的部分数据:
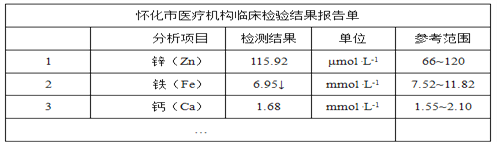
根据上表的数据,回答下列问题:
(1)该儿童__元素含量偏低。
(2)报告单中“μmol·L-1”是__(填“质量” “体积”或“浓度”)的单位。
(3)服用维生素C可使食物中的Fe3+转化为Fe2+。在这个过程中维生素C表现出__________(填“氧化性”或“还原性”)。
(4)硫酸亚铁晶体(FeSO47H2O)在医疗上可作补血剂。某课外小组测定该补血剂(每片b克)中铁元素的含量。实验步骤如图:
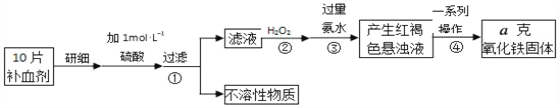
请回答下列问题:
a.②中H2O2的作用是__。
b.④中一系列处理的操作步骤为过滤、______、灼烧、冷却、称量。
c. 下列操作会导致所测定的铁元素含量偏高的是__。
A.步骤③所加氨水量不足 B.步骤④洗涤不充分 C.步骤④灼烧不充分
d. 写出步骤③中发生的离子方程式_____________________________________
e、简述滤液中存在Fe3+的检验方法是:_______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列各题:
(1)微粒铵根14N2H4+中的中子数是___________________ ,核外电子数是_____。
(2)写出 N2的电子式_________________,画出HClO分子的结构式_________________
CO2的电子式________________;Na2O2的电子式为___________________
(3)如图是元素周期表的一个方格  ,其中19.00的意义是______________
,其中19.00的意义是______________
(4) 25℃,101 kPa,1g C2H2气体充分燃烧生成气体CO2和液态H2O,放出125kJ的热量,写出C2H2燃烧热的热化学方程式_________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com