
��8�֣�����þ��ҽ���Ͼ��������εȹ�Ч������þ����Ҫ�ɷ���MgCO3��Ϊ��Ҫԭ���Ʊ�����þ�ķ������£�

��1��������з�����Ӧ�����ӷ���ʽΪ ��
��2��������е���pH=6.0~6.5��Ŀ���� ��
��3������ݵIJ���Ϊ
��4����֪���ָʾ�����������ɫ��pH��Χ�����ʾ��
pH | < 8.0 | 8.0 ~ 9.6 | > 9.6 |
��ɫ | ��ɫ | ��ɫ | ��ɫ |
25��ʱ����Mg(OH)2�ı�����Һ�еμ�2�ΰ������ָʾ������Һ�����ֵ���ɫ
Ϊ [25��ʱ��Ksp[Mg(OH)2] =5.6��10-12]��
��8�֣�
��1��2NH4+ + MgO��Mg2+ + 2NH3��+ H2O ��2�֣�
��2������Mg2+ˮ�⣬�Ա�õ���������IJ�Ʒ ��2�֣�
��3������Ũ������ȴ�ᾧ��2�֣�
��4����ɫ��2�֣�
��������
�����������1��MgO���������Һ���ȷ�Ӧ���ɵ����������ᷴӦ��������泥�˵���������ǰ�������MgO������識��ȵIJ������а�����˵��MgO�ļ��룬�ٽ�笠����ӵ�ˮ�⣬���ɰ������õ�����������MgO��Ӧ����þ���Ӻ�ˮ�����Բ�����з�����Ӧ�����ӷ���ʽΪ2NH4+ + MgO��Mg2+ + 2NH3��+ H2O��
��2���õ�������þ��Һ��þ����ˮ�⣬�ò����ϴ�������þ��������Ϊ����þ����ˮ�⣬������е���pH=6.0~6.5���Ա�õ���������IJ�Ʒ��
��3������Һ�õ���������еIJ���������Ũ������ȴ�ᾧ�����Բ���ݵIJ���Ϊ����Ũ������ȴ�ᾧ��
��4�����͵�������þ��Һ����Mg(OH)2 ��s��= Mg2+��aq�� + 2 OH-��aq���ܽ�ƽ�⣬2c��Mg2+��= c��OH -�������ܶȻ�Ksp= c��Mg2+��c2��OH -��=5.6��10-12 ���ɴ˿��Եó�c��OH -��=2.24��10-4 ��c��H+��=1��10-14/2.24��10-4 =4.5��10-11������pH>9.6�����Լ���������ָʾ������Һ����ɫ��
���㣺����þ���仯�������ʵ�Ӧ�ã��Թ�ҵ���̵ķ���������������жϣ��ܶȻ��ļ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015�츣��ʡ������ѧ�ڰ���������ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ����
A�� ��
�� ����������ͬ ������
����������ͬ ������ ��
�� ��Ϊͬλ�ء�
��Ϊͬλ�ء�
B��1 mol CH4��1 mol NH �������������
�������������
C�������ʵ����ļ�(-CH3)���ǻ�(-OH)�������������
D��������������ˮ���õ���Һ�ɵ��磬˵�����������ǵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ����9���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
ij��Һ�п��ܺ�������6�������еļ��֣�NH4+��A13+��Mg2+��CO32�D��Clһ��SO42�D��Ϊȷ����Һ��ɣ���ȡ100 mL�ֳ����ȷ���Һ��������ʵ�飺
��1�����һ����Һ�м��� AgNO3��Һ�г���������
��2����ڶ�����Һ�м�������NaOH��Һ��ַ�Ӧ�����յõ�����0.58 g��ͬʱ�ռ�������0.03 mol(������ȫ������Һ���ݳ�)��
��3�����������Һ�м�������BaCl2��Һ(�����ữ)��ַ�Ӧ�õ�����6.99 g���ɴ˿�֪�����й���ԭ��Һ��ɵ���ȷ�����ǣ� ��
A��һ������Clһ B����Һ�к���A13+��NH4+
C��һ��������Mg2+�����ܴ���A13+ D����Һ��SO42�D��Ũ����0.03 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ����10���¿����ۻ�ѧ�Ծ��������棩 ���ͣ������
(17��) �ȼ��ⱥ��ʳ��ˮ��ȡ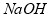 �Ĺ�������ʾ��ͼ���£�
�Ĺ�������ʾ��ͼ���£�
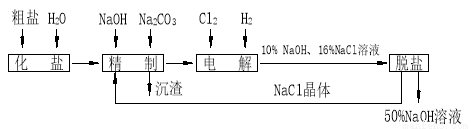
������ͼ�����������գ�
��1���ڵ������У����Դ���������ĵ缫����������Ӧ�Ļ�ѧ����ʽΪ_________________________________�����Դ���������ĵ缫��������Һ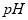 ֵ___________����ѡ����䡢�����½���
ֵ___________����ѡ����䡢�����½���
��2����ҵʳ�κ�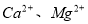 �����ʣ����ƹ��̷�����Ӧ�����ӷ���ʽΪ____________________________________________��
�����ʣ����ƹ��̷�����Ӧ�����ӷ���ʽΪ____________________________________________��
��3�����������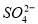 �����ϸߣ��������ӱ��Լ���ȥ
�����ϸߣ��������ӱ��Լ���ȥ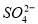 ���ñ��Լ�������________��ѡ��a��b��c��ѡ���۷֣�
���ñ��Լ�������________��ѡ��a��b��c��ѡ���۷֣�
a. 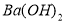 b.
b. 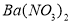 c.
c. 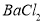
��4��Ϊ��Ч��ȥ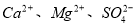 �������Լ��ĺ���˳��Ϊ_____________��ѡ��a��b��c��ѡ���۷֣�
�������Լ��ĺ���˳��Ϊ_____________��ѡ��a��b��c��ѡ���۷֣�
a. �ȼ�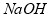 �����
�����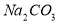 ���ټӱ��Լ�
���ټӱ��Լ�
b. �ȼ�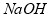 ����ӱ��Լ����ټ�
����ӱ��Լ����ټ�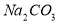
c. �ȼӱ��Լ������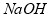 ���ټ�
���ټ�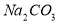
��5�������������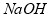 ��
��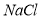 ���ܽ���ϵIJ��죬ͨ��____________����ȴ��______________����д�������ƣ���ȥ
���ܽ���ϵIJ��죬ͨ��____________����ȴ��______________����д�������ƣ���ȥ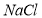 ��
��
��6���ڸ�Ĥ�����ʳ��ˮʱ�����۷ָ�Ϊ������������������ֹ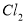 ��
��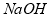 ��Ӧ��������Ĥ������ʳ��ˮʱ��
��Ӧ��������Ĥ������ʳ��ˮʱ��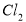 ��
��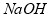 ��ֽӴ����������
��ֽӴ����������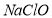 ��
�� ����Ӧ�Ļ�ѧ����ʽΪ_____________________��
����Ӧ�Ļ�ѧ����ʽΪ_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ����10���¿����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
���淴Ӧ2A(g)+B(g) 2C(g)�������±��е������ж�����ͼ��������( )
2C(g)�������±��е������ж�����ͼ��������( )

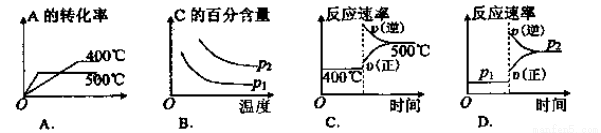
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ������ѧ�ڵڶ��μ�⿼�Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
þ���仯����һ����(��Ͷ�)������Ⱦ����þԭ��طŵ�ʱ��ѹ�߶�ƽ�ȣ�ʹþԭ���Խ��Խ��Ϊ����������ɫԭ��صĹ�ע���㡣����һ��þԭ��صķ�ӦΪ��
x Mg+Mo3S4  Mgx Mo3S4 ������˵��������ǣ� ��
Mgx Mo3S4 ������˵��������ǣ� ��
A���ŵ�ʱMg2+������Ǩ��
B�����ʱ������ӦΪ��Mo3S42x-��2xe? =Mo3S4
C�����ʱMo3S4����������Ӧ
D���ŵ�ʱ������ӦΪ��xMg ? 2xe? = xMg2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ������ѧ�ڵڶ��μ�⿼�Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��NA���������ӵ�����������������ȷ����
A����״���£�11.2L��O2��NO�Ļ���ﺬ�еķ�����ԼΪ0.5��6.02��1023
B��1mol���ǻ���1 mol������������������������Ϊ9 NA
C�����³�ѹ��42g ��ϩ�Ͷ�ϩ��������У����Լ���Ϊ6NA
D��6.4g SO2������������Ӧ����SO3��ת�Ƶ�����Ϊ0.2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ������һ��������ѧ�Ծ��������棩 ���ͣ�ѡ����
��AlCl3��MgCl2�Ļ����Һ�У���μ���NaOH��Һֱ�����������ⶨ������NaOH����������ó��������ʵ����Ĺ�ϵ����ͼ��ʾ��b��NaOH��Һ�����Ϊ1L�����������жϲ���ȷ���ǣ�������

A�� NaOH��Ũ��Ϊ0.6mol/L B����a�㴦��Һ�е�����ΪNaCl
C����b�㴦��Һ�е�����ֻ��NaAlO2 D��ͼ���߶�oa��ab=5��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ��ˮ�и�һ��ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ������
(12��)ijһ��Ӧ��ϵ���з�Ӧ��������ﹲ�������ʣ�O2��H2CrO4��Cr(OH)3��H2O��H2O2����֪�÷�Ӧ��H2O2ֻ�������¹��̣�H2O2 O2
O2
��1���÷�Ӧ�еĻ�ԭ����
��2���÷�Ӧ�У�������ԭ��Ӧ�Ĺ����� 
��3��д���÷�Ӧ�Ļ�ѧ����ʽ������˫���ŷ��������ת�Ƶķ������Ŀ��
��4������Ӧת����0��3mol���ӣ�������������ڱ�״�������Ϊ L
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com