
下列叙述中正确的是
A.只含离子键的化合物才是离子晶体
B.(NH4)2SO4晶体是含有离子键、极性共价键和配位键的晶体
C.由于I—I中的共价键键能比F—F、Cl—Cl、Br—Br都弱,因此在卤素单质中I2的熔点、沸点最低
D.液态氯化氢能导电,说明氯化氢不是共价化合物
【解析】含有离子键的化合物就是离子化合物,在离子化合物中可以有共价键,A不正确。在NH4+中含有配位键和极性键,B正确。卤素单质形成的晶体是分子晶体,其熔沸点与分子间作用力有关,而与化学键无关,碘的熔沸点是最高的,C不正确。液态氯化氢不能电离,所以不能导电,D是错误的。答案选B。
科目:高中化学 来源: 题型:
(2013?奉贤区二模)由A、B、C、D四种金属按表中装置进行实验,下列叙述中正确的是( )
| |||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
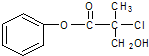 有机物A是农药生产中的一种中间体,结构简式如图所示.下列叙述中正确的是( )
有机物A是农药生产中的一种中间体,结构简式如图所示.下列叙述中正确的是( )| A、有机物A可以在一定条件下与HBr发生反应 | B、1mol A最多能与4mol H2发生加成反应 | C、有机物A与浓硫酸混合加热,可以发生消去反应 | D、1mol A与足量的NaOH溶液反应,最多可以消耗3mol NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com