
【题目】MnSO4·H2O在工业、农业等方面有广泛的应用。软锰矿-黄铁矿硫酸浸出法是工业上制取硫酸锰的一种方法。
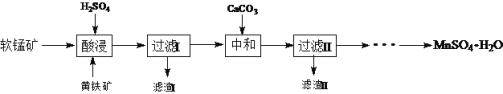
(1)酸浸时主要反应为15MnO2+2FeS2+14H2SO4= 15MnSO4 + Fe2(SO4)3 +14H2O,反应中被氧化的元素是____。酸浸时,硫酸过量的目的是:①____;②____。
(2)加入CaCO3可以将滤液中的Fe3+转化为Fe(OH)3而除去,该反应的化学方程式为____。CaCO3用量过大,对MnSO4·H2O产量的影响是,____(填“升高”“降低”或“无影响”)。
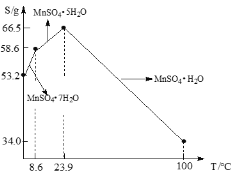
(3)硫酸锰在不同温度下结晶可分别得到MnSO4·7H2O、MnSO4·5H2O和MnSO4·H2O。硫酸锰在不同温度下的溶解度和该温度范围内析出晶体的组成如下图所示。从过滤Ⅱ所得的滤液中获得较高纯度MnSO4·H2O的操作是:控制温度在80 ℃~90 ℃之间蒸发结晶,____,使固体MnSO4·H2O与溶液分离,____、真空干燥。
【答案】Fe、S(或铁、硫) 提高锰元素的浸出率 抑制Mn2+水解 Fe2(SO4)3++3H2O + 3CaCO3 = 2Fe(OH)3 + 3CaSO4 + 3CO2↑ 降低 趁热过滤 用80℃~90℃的蒸馏水洗涤2~3次
【解析】
根据流程中发生的化学反应,应用混合物分离提纯的方法,逐步分析回答问题。
(1)酸浸主要反应中,锰从+4降至+2价,被还原;铁从+2升至+3价、硫从-1升至+6价,被氧化。使用过量的硫酸,可使软锰矿充分反应,提高锰元素的浸出率;多余的硫酸可抑制Mn2+、Fe3+水解,防止Mn2+生成沉淀而损失。
(2)过滤I所得滤液中Fe3+水解Fe3++3H2O![]() Fe(OH)3+3H+,中和时加入的CaCO3与H+反应CaCO3+2H+=Ca2++CO2↑+H2O,水解平衡右移Fe3+转化为Fe(OH)3沉淀,总反应的化学方程式为Fe2(SO4)3+3H2O + 3CaCO3 = 2Fe(OH)3 + 3CaSO4 + 3CO2↑。若CaCO3用量过大,部分Mn2+水解转化成Mn(OH)2沉淀混入滤渣II,使MnSO4·H2O产量降低。
Fe(OH)3+3H+,中和时加入的CaCO3与H+反应CaCO3+2H+=Ca2++CO2↑+H2O,水解平衡右移Fe3+转化为Fe(OH)3沉淀,总反应的化学方程式为Fe2(SO4)3+3H2O + 3CaCO3 = 2Fe(OH)3 + 3CaSO4 + 3CO2↑。若CaCO3用量过大,部分Mn2+水解转化成Mn(OH)2沉淀混入滤渣II,使MnSO4·H2O产量降低。
(3)据溶解度曲线图,要从过滤Ⅱ所得MnSO4溶液中获得较高纯度的MnSO4·H2O晶体,应在80 ℃~90 ℃之间进行蒸发结晶、趁热过滤,再用80℃~90℃的蒸馏水洗涤MnSO4·H2O晶体2~3次,最后真空干燥。


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案科目:高中化学 来源: 题型:
【题目】在某密闭容器中,可逆反应:A(g) + B(g)![]() xC(g)符合图中(Ⅰ)所示关系:
xC(g)符合图中(Ⅰ)所示关系:![]() (C)表示C气体在混合气体中的体积分数。由此判断,对图像 (Ⅱ) 说法不正确的是:
(C)表示C气体在混合气体中的体积分数。由此判断,对图像 (Ⅱ) 说法不正确的是:

A.p3>p4,Y轴表示A的转化率
B.p3>p4,Y轴表示B的质量分数
C.p3>p4,Y轴表示B的转化率
D.p3>p4,Y轴表示混合气体的平均相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用NaI溶液中通入少量Cl2得到含碘废液,再利用含碘废液获取NaI固体,实验流程如下:

已知反应②:2I﹣+2Cu2++![]() +H2O
+H2O![]() 2CuI↓+
2CuI↓+![]() +2H+。
+2H+。
回答下列问题:
(1)过滤实验所需要的玻璃仪器有普通漏斗、烧杯、_____________。
(2)反应③中CuI被氧化,还原产物只有NO2,该反应的化学方程式为_________________。当有95.5 g CuI参与反应,则需要标况下______________L的O2才能将生成的NO2在水中完全转化为硝酸。
(3)化合物B中含两种元素,铁原子与另一种元素原子的物质的量之比为3∶8,则化合物B的化学式为_____________。
(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则反应⑤的化学方程式为______。
(5)将足量的Cl2通入含12 g NaI的溶液中,一段时间后把溶液蒸干得到固体的质量为_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池反应为:Pb + PbO2 + 2H2SO4![]() 2PbSO4 + 2H2O 。下列说法中正确的是
2PbSO4 + 2H2O 。下列说法中正确的是
A. PbO2得电子,被氧化
B. 铅蓄电池工作过程中每通过2mol电子,负极质量减少207g
C. 电流是由PbO2经外电路流向Pb
D. 电池放电时,溶液酸性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C在周期表中所处的位置如图所示。A、B、C三种元素原子的质子数和为32。D元素原子的最外层电子数是其次外层电子数的2倍。则下列说法正确的是

A. 元素D的某种同位素质量数为14,则其中子数为6
B. 四种元素形成的气态氢化物中,C元素的氢化物的稳定性最强
C. B、C两种元素可形成BC6型化合物,该化合物属于离子化合物
D. A、B两种元素的气态氢化物均能与它们对应的最高价氧化物对应的水化物发生反应,且都属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铜矿石的主要成分是Cu2O,还含有少量的Al2O3、Fe2O3和SiO2。某工厂利用此矿石炼制精铜的工艺流程如图所示(已知:Cu2O+2H+===Cu+Cu2++H2O)。
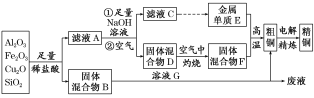
(1)滤液A中铁元素的存在形式为________________(填离子符号),生成该离子的离子方程式为____________________________,检验滤液A中存在该离子的试剂为__________________。
(2)溶液G与固体混合物B反应的离子方程式为__________________________________________________。
(3)将Na2CO3溶液滴入到一定量的CuCl2溶液中,得到氯化钠、二氧化碳和一种绿色的不溶于水的盐(不含结晶水),该盐受热分解产生三种氧化物,则该盐的化学式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电动汽车以锂电池提供动力,锂电池技术已经成为汽车研究的前沿科技某锂电池的电池反应为:xLi+Li3-xNiCoMnO6![]() Li3NiCoMnO6,下列说法正确的是
Li3NiCoMnO6,下列说法正确的是![]()
A. 该电池的充、放电过程互为可逆反应
B. 放电时,电池的负极反应为Li-e-=Li+
C. 放电过程中,Li+向电池的负极移动
D. 该电池可以采用醋酸、乙醇等作为电解质溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示。下列结论不正确的是
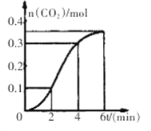
A.反应开始2分钟内平均反应速率最大
B.反应4分钟后平均反应速率最小
C.反应开始4分钟内温度对反应速率的影响比浓度大
D.反应4分钟后反应速率下降的原因是盐酸浓度逐渐减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com