
右图为摇摆电池的工作原理图,在充放电过程中Li+在两极间“摇来摇去”,其总反应为:LiCoO2+6C  Li(1-x)CoO2+ LixC6 下列有关说法正确的是
Li(1-x)CoO2+ LixC6 下列有关说法正确的是
 A. 放电时,负极反应为:
A. 放电时,负极反应为:
LiCoO2—= Li(1-x)CoO2 + xLi+
B. 充电时,B极发生还原反应
C. 充电时,Li+穿过隔离膜向B极移动
D. 当A极得到x mol电子,电池消耗6 mol C
科目:高中化学 来源: 题型:
普罗帕酮为广谱高效抗心律失常药,它可由有机物X经多步反应合成:
|
|

下列有关说法正确的是
A.在有机物X的1H核磁共振谱图中,有4组特征峰
B.可用溴水或FeCl3溶液鉴别X和Y
C.普罗帕酮分子中有2个手性碳原子
D.X、Y和普罗帕酮都能发生加成、水解、氧化、消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、R、W是5种短周期元素,原子序数依次增大;它们可组成离子化合物Z2Y和共价化合物RY3、XW4;已知Y、R同主族, Z、R 、W同周期。下列说法错误的是( )
A.原子半径:Z>R>W
B.W的气态氢化物稳定性强于R的气态氢化物
C.XW4分子中各原子均满足8电子结构
D.Y、Z、R三种元素组成的化合物水溶液一定显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式不正确的是
A. 三氯化铝溶液中加入过量氨水:Al3++4NH3·H2O==4NH4++AlO2—+2H2O
B. 4 mol/L的NaAlO2溶液和7 mol/L的HCl溶液等体积互相均匀混合:
4AlO2—+7H++H2O = 3Al(OH)3↓+Al3+
C. 在Mn2+的溶液中加入HNO3再加入PbO2,得紫红色溶液:
5PbO2+2Mn2++4H+ = 5Pb2++2MnO4—+2H2O
D. 将数滴0.1 mol/L的Na2CO3溶液缓缓滴入0.1 mol/L 25 mL盐酸溶液中:2H++ CO32— =CO2↑+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,向一定体积0.1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶
 液,溶液中pOH [ pOH=-lg(OH—) ]与pH的变化
液,溶液中pOH [ pOH=-lg(OH—) ]与pH的变化
关系如图所示,则下列说法正确的是
A.M点所示溶液导电能力强于Q点
B.M点和N点所示溶液中水的电离程度相同
C. N点所示溶液中c(CH3COO-)>c(Na+)
D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
I.(10分)四种短周期元素X、Y、Z、W,原子序数依次增大,请结合表中
信息回答下列问题。
| X | Y | Z | W | |
| 结构 或 性质 | X的最高价氧化物对应的水化物与其气态氢化物反应可得到一种盐 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,Z的离子半径最小 | 原子核外最外层电子数是次外层电子数的一半 |
(1)用电子式表示X的氢化物的形成过程_____________________________。
(2)W元素在周期表中的位置为____________________。
(3)上述元素的最高价氧化物对应的水化物中,有一种物质甲与其它三种物质在一定条件下均能发生化学反应,则甲中所含的化学键有________(填序号)。
a.离子键 b.极性共价键 c.非极性共价键 d.氢键
(4)向含有Z元素的简单阳离子的溶液中加入过量的NaOH溶液,发生反应的离子方程式为_____________________________________。
(5)下列可作为比较Z和Mg金属性强弱的方法是_______(填代号)。
a.比较两种元素在化合物中化合价的高低
b.测等浓度相应氯化物水溶液的pH
c.在常温条件下比较单质与浓硝酸反应的剧烈程度
d.在两种金属氯化物的水溶液中分别滴加过量的NaOH溶液
II.(8分)多种物质的转化关系如下图所示(部分反应物或产物已略去,反应条件未列出):

已知:①A、B、C、D、G含有同种元素,且它们的状态与颜色如下表
所示:

②E是通常情况下密度最小的气体;B与AgNO3生成不溶于稀硝酸的白色沉淀;一种气体氧化物M通入B溶液中可被氧化为F,F是含有三种元素的共价化合物,F与A反应生成E和G。
请回答下列问题:
(1)写出下列物质的化学式:D___________;E__________。
(2)写出下列反应的离子方程式:
①B+M→F:________________________________________;
②A+F→E+G:______________________________________。
(3)下列氧化物中能与G溶液反应直接生成C固体的是_______(填字母)。
a.Na2O2 b.SO2 c.CO2 d.BaO2
查看答案和解析>>
科目:高中化学 来源: 题型:
一种一元强酸HA溶液中加入一种碱MOH,溶液呈中性,下列判断正确的是
A.加入的碱过量 B.反应后溶液中c(A-)= c(M+)
C.生成的盐发生水解 D.混合前酸与碱中溶质的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下:
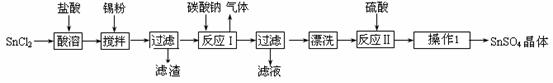
查阅资料:Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡。请回答下列问题:
(1)操作Ⅰ步骤是 ▲ 。
(2)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因 ▲ 。
(3)加入Sn粉的作用有两个:①调节溶液pH ② ▲ 。
(4)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是 ▲ 。
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是 ▲ 。
(6)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn + 2HCl===SnCl2 + H2↑;
②加入过量的FeCl3溶液;
③用已知浓度的K2Cr2O7滴定②中生成的Fe2+,发生的反应为:
6FeCl2 + K2Cr2O7 + 14HCl ===6FeCl3 + 2KCl + 2CrCl3 +7H2O
取1.190 g 锡粉,经上述各步反应后,共用去0.100 mol/L K2Cr2O7溶液25.00 mL。锡粉中锡的质量分数是 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数的值。下列叙述正确的是 ( )。
A.42 g C3H6中含有的共用电子对数目为8 NA
B.电解饱和食盐水时,当0.1 mol NaCl反应时,转移的电子数为0.1 NA
C.常温常压下,22.4 L N2和O2的混合气体中含有的分子数目为NA
D.1 L 0.01 mol·L-1 KAl(SO4)2溶液中含有的阳离子数目为0.02 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com