
实验室需要0.1 mol/L NaOH溶液450 mL和0.5 mol/L硫酸溶液450 mL.根据这两种溶液的配制情况回答下列问题:
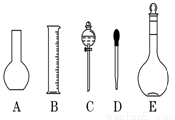
(1)如图所示的仪器中配制溶液肯定不需要的是 (填序号),仪器E的名称是 ,本实验所需玻璃仪器E规格为 mL。
(2)下列操作中,容量瓶所不具备的功能有 (填序号)。
A.配制一定体积准确浓度的标准溶液 B.长期贮存溶液
C.用来加热溶解固体溶质 D. 量取一定体积的液体
(3)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为 mL
(计算结果保留一位小数)。如果实验室有10 mL、25mL、50 mL量筒,应选用 mL规格的量筒最好。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2015-2016学年西藏日喀则中学高二上12月月考化学试卷(解析版) 题型:选择题
相同体积的pH=3的强酸溶液和弱酸溶液分别跟足量的镁完全反应,下列说法正确是( )
A.弱酸溶液产生较多的氢气
B.强酸溶液产生较多的氢气
C.两者产生等量的氢气
D.无法比较两者产生氢气的量
查看答案和解析>>
科目:高中化学 来源:2016届重庆市高三上学期第三次月考理综化学试卷(解析版) 题型:选择题
一定条件下合成乙烯:6H2(g)+2CO2(g) CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是:
CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是:
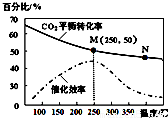
A.生成乙烯的速率:v(M)有可能小于v(N)
B.平衡常数:KM>KN
C.当温度高于250℃,升高温度,平衡向逆反应方向移动,从而使催化剂的催化效率降低
D.若投料比n(H2):n(CO2)=3:1,则图中M点时,乙烯的体积分数为7.7%
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高二上期中测试化学试卷(解析版) 题型:填空题
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在485℃时,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应合成甲醇:
(1)请完成CO2和3mol H2反应合成甲醇的热化学方程式:
CO2(g)+3H2(g)  CH3OH(g)+______( ),△H=-49.0kJ/mol
CH3OH(g)+______( ),△H=-49.0kJ/mol
(2)测得CO2和CH3OH(g)的浓度随时间变化如图所示。

①从反应开始到平衡,氢气的平均反应速率v(H2)= ___________mol/(L·min)。
②该反应的平衡常数表达式为__________________。
③据图中提供的数据计算在该温度下的K值。要有计算过程。(保留三位有效数字)
(3)能判断该反应是否达到化学平衡状态的依据是___________(多选扣分)
A.容器中压强不变的状态 B.混合气体中c(CO2)不变的状态
C.V逆(H2O)=3 V正 (H2) D.混合气体的密度保持不变的状态
E.用CO2、H2、CH3OH的物质的量浓度变化表示的反应速率的比为1:3:1的状态
F.混合气体的平均相对分子质量不再改变的状态
(4)下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二上11月月考化学试卷(解析版) 题型:实验题
某课外活动小组用如图装置进行实验,试回答下列问题:
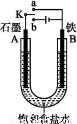
(1)若开始时开关K与a连接,则B极的电极反应为 。
(2)若开始时开关K与b连接,则B极的电极反应为 ,总反应的离子方程式为 。
(3)有关上述实验,下列说法正确的是 。
A.溶液中Na+向A极移动
B.从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
C.反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
D.若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(4)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
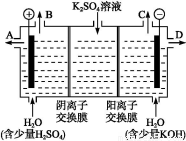
①该电解槽的阳极反应为 。 此时通过阴离子交换膜的离子数 (填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填“A”、“B”、“C”或 “D”)________导出。
③电解过程中阴极区碱性明显增强,用平衡移动原理解释原因__________________________
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三上学期期中测试化学试卷(解析版) 题型:填空题
HNO3与金属反应时,还原产物可能是NO2、NO、N2O、N2或NH3的一种或几种。现有一定量的Al粉和Fe粉的混合物与100mL稀HNO3充分反应,反应过程中无任何气放出。在反应结束后的溶液中,逐渐加入4 mol·L-1的NaOH溶液,加入NaOH溶液的体积(mL)与产生沉淀的物质的量关系如下图。请回答:
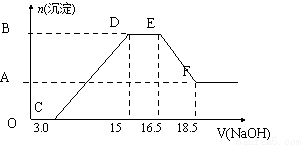

(1)与HNO3反应后Fe元素的化合价是_____________
(2)纵坐标中A点数值是______________,B点数值是____________,原HNO3浓度是______________
查看答案和解析>>
科目:高中化学 来源:2016届云南省高三上第四次月考理综化学试卷(解析版) 题型:选择题
下表中实验操作、现象和所得出的结论均正确的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
B | 向氯化亚铁溶液中加入Na2O2粉末 | 出现红褐色沉淀 | 说明原氯化亚铁已氧化变质 |
C | 碳酸盐X加热分解,产生的气体通入酸化的BaCl2溶液 | 产生白色沉淀 | X可能是NaHCO3 |
D | 湿润的KI淀粉试纸靠近气体Y | 试纸变蓝 | Y一定是Cl2 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年海南省高二上12月段考化学试卷(解析版) 题型:填空题
煤气化和液化是现代能源工业中重点考虑的能量综合利用方案。最常见的气化方法为用煤生成水煤气,而当前比较流行的液化方法用煤生成CH3OH。
(1)已知:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H1
2CO(g)+O2(g)=2CO2(g) △H2
2H2(g)+O2(g)=2H2O(g) △H3
则反应CO(g) +2H2(g)=CH3OH(g) 的△H=_______。
(2)如图是该反应在不同温度下CO的转化率随时间变化的曲线。
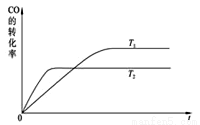
①T1和T2温度下平衡常数大小关系是K1____K2(填“>”“<”或“=”)。
②由CO合成甲醇时,CO在250℃、300℃、350℃下达到平衡时转化率与压强的关系曲线如下图所示,则曲线c所表示的温度为______℃,实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是______。
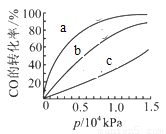
③以下有关该反应的说法正确的是_________(填序号)。
A.恒温、恒容条件下同,若容器内的压强不发生变化,则可逆反应达到平衡
B.一定条件下,H2的消耗速率是CO的消耗速率的2倍时,可逆反应达到平衡
C.使用合适的催化剂能缩短达到平衡的时间并提高CH3OH的产率
D.某温度下,将2molCO和6molH2充入2L密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为80%
(3)一定温度下,向2L固定体积的密闭容器中加入1molCH3OH,发生反应:CH3OH(g)  CO(g) +2H2(g),H2的物质的量随时间变化的曲线如图所示。
CO(g) +2H2(g),H2的物质的量随时间变化的曲线如图所示。
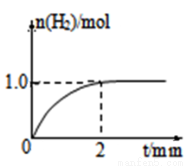
0~2min内的平均反应速率v(CH3OH)= ____________;该温度下,CO(g)+2H2(g) CH3OH(g)的平衡常数K=____________;相同温度下,若开始加入CH3OH(g)的物质的量是原来的2倍,则_____ 是原来的2倍.
CH3OH(g)的平衡常数K=____________;相同温度下,若开始加入CH3OH(g)的物质的量是原来的2倍,则_____ 是原来的2倍.
A.平衡常数 B.CH3OH的平衡浓度 C.达到平衡的时间 D.平衡时气体的密度
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高二上第二次质检化学试卷(解析版) 题型:选择题
对于易燃、易爆、有毒的化学物质,往往会在其包装上贴上危险警告标签。下面所列物质中,标签贴错的是
A | B | C | D | |
物质的化学式 | 浓H2SO4 | 汽油 | 乙醇 | KNO3 |
危险警告标签 |
腐蚀品 |
易燃液体 |
剧毒品 |
爆炸品 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com