二氧化碳作为未来碳源,既可弥补因石油、天然气等大量消耗引起的“碳源危机”,又可有效地解决温室效应.目前,人们利用光能和催化剂,可将CO
2和H
2O(g)转化为CH
4和O
2.某研究小组选用不同的催化剂(a,b,c),获得的实验结果如图1所示.
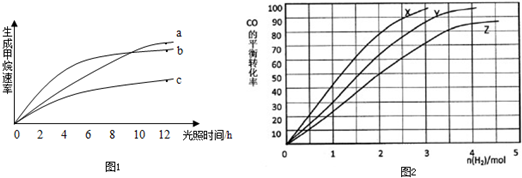
请回答下列问题:
(1)反应开始后的12小时内,在
(填a、b、c)的作用下,收集CH
4的最多.
(2)将所得CH
4与H
2O(g)通入聚焦太阳能反应器,发生反应CH
4(g)+H
2O(g)?CO(g)+3H
2(g)△H=+206kJ?mol
-1.将等物质的量的CH
4和H
2O(g)充入1L恒容密闭容器,某温度下反应5min后达到平衡,此时测得CO的物质的量为0.10mol,则5min内CH
4的平均反应速率为
.平衡后可以采取下列
的措施能使 n(CO)/n(CH
4)增大.
A.加热升高温度 B.恒温恒容下充入氦气
C.恒温下增大容器体积 D.恒温恒容下再充入等物质的量的CH
4和H
2O
(3)该反应产生的CO和H
2可用来合成可再生能源甲醇,已知CO(g)、CH
3OH(l)、H
2(g)的燃烧热△H分别为-283.0kJ?mol
-1、-726.5kJ?mol
-1和-285.8kJ?mol
-1,则CO(g)和H
2(g)合成CH
3OH(l)的热化学方程式为
.
(4)某科研人员为研究H
2和CO合成甲醇的最佳起始组成比n(H
2):n(CO),在1L恒容密闭容器中通入H
2与CO的混合气(CO的投入量均为1mol),分别在230℃、250℃和270℃进行试验,测得结果如图2,则230℃时的实验结果所对应的曲线是
(填字母);理由是
.列式计算270℃时该反应的平衡常数K:
.



