
| A、1L溶液中K+浓度是0.4mol?L-1 |
| B、500mL溶液中含有0.1NA个K+ |
| C、1L溶液中所含K+和SO42-总数为0.3NA |
| D、2L溶液中SO42-浓度 为0.4mol?L-1 |


科目:高中化学 来源: 题型:
| A、需要加热方能发生的反应一定是吸热反应 |
| B、放热反应在常温下一定很容易发生 |
| C、反应是放热还是吸热,必须看反应物和生成物所具有的总能量的相对大小 |
| D、化学反应只生成新物质,没有能量的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、实验证实环辛四烯( )可使Br2的CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键 )可使Br2的CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键 |
B、已知视网醛的结构为 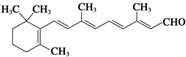 ,在它的同分异构体中属于萘( ,在它的同分异构体中属于萘( 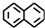 )的衍生物且能发生银镜反应的不止一种 )的衍生物且能发生银镜反应的不止一种 |
| C、三硝酸甘油酯的分子式为C3H5N3O9 |
| D、丙醇依次通过消去、加成、取代、去氢氧化、加氧氧化、还原反应可生成乳酸(2-羟基丙酸) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、30g?mol-1 |
| B、60g?mol-1 |
| C、90g?mol-1 |
| D、120g?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2+H2O=H2CO3 化合反应 |
| B、H2CO3=CO2↑+H2O 分解反应 |
| C、3CO+Fe2O3=2Fe+3CO2 置换反应 |
| D、CuO+H2=Cu+H2O氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=2的硝酸和pH=12的Ba(OH)2溶液 |
| B、pH=3的盐酸和pH=11的氨水 |
| C、pH=3的硫酸和pH=11的KOH |
| D、pH=4的醋酸和pH=10的KOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
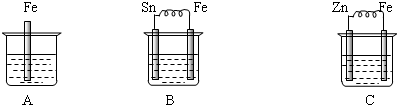
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com