
| A. | R原子的电子数为10+n | B. | R能形成Rn-离子 | ||
| C. | R的最高氧化物为R2On或ROn/2 | D. | R的气态氢化物的化学式是H8-nR |
分析 A.非金属元素R位于第三周期,其原子的最外层有n个电子,有3个电子层,各层电子数为2、8、n;
B.属于非金属,可以形成阴离子,带(8-n)的单位负电荷;
C.最高正化合价为n,讨论n的奇偶性书写氧化物化学式;
D.最低负化合价为-(8-n),进而书写氢化物化学式.
解答 解:A.非金属元素R位于第三周期,其原子的最外层有n个电子,有3个电子层,各层电子数为2、8、n,原子的电子数为10+n,故A正确;
B.属于非金属,可以形成阴离子,带(8-n)的单位负电荷,可能形成R(8-n)-离子,故B错误;
C.最高正化合价为n,n为奇数时,氧化物化学式为R2On,n为偶数时,氧化物化学式为RO$\frac{n}{2}$,故C正确;
D.最低负化合价为-(8-n),氢化物化学式为H8-nR,故D正确,
故选B.
点评 本题考查原子结构与元素性质,难度不大,C选项为易错点,学生容易忽略n的奇偶性问题.


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:选择题
| A. | 浊液中存在沉淀溶解平衡:AgCl(s)?Ag+(aq)+CI-(aq) | |
| B. | 实验可以证明NH3结合Ag+能力比Cl-强 | |
| C. | 实验表明实验室可用氨水洗涤银镜反应后的试管 | |
| D. | 由资料信息可推知:加浓硝酸后生成的沉淀为AgCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 分子中所有原子在同一平面上 | |
| B. | 分子中含有2种官能团 | |
| C. | 可发生加成和取代反应 | |
| D. | 在水溶液中羟基和羧基均能电离出H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
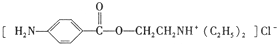 )是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下:
)是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下: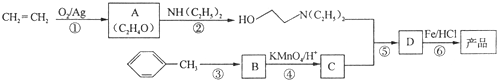
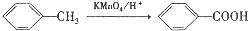
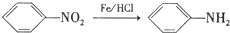
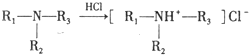
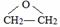 .
.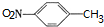 ,C中含氧官能团的名称为硝基、羧基.
,C中含氧官能团的名称为硝基、羧基.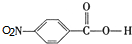 +HOCH2CH2N(C2H5)2$\stackrel{一定条件下}{→}$
+HOCH2CH2N(C2H5)2$\stackrel{一定条件下}{→}$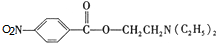 +H2O.
+H2O.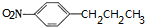 (任写一种).
(任写一种).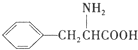 )是人体必需的氨基酸之一,写出其发生缩聚反应的化学方程式
)是人体必需的氨基酸之一,写出其发生缩聚反应的化学方程式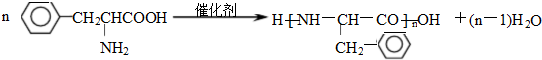 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na3PO4 | B. | Na4P2O7 | ||
| C. | Na4P2O7 和Na5P3O10 | D. | Na3PO4、Na4P2O7和Na5P3O10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com