
一定条件下,对于可逆反应N2(g)+3H2(g)⇌2NH3(g),若X、Y、Z的起始浓度分别为C1、C2、C3(均不为零),到达平衡时,N2、H2、NH3的浓度分别为0.1mol•L﹣1、0.3mol•L﹣1、0.08mol•L﹣1,则下列判断正确的是( )
|
| A. | C1:C2=1:3 |
|
| B. | 平衡时,H2和NH3的生成速率之比为2:3 |
|
| C. | N2、H2的转化率之比为1:3 |
|
| D. | C1的取值范围为0.04mol•L﹣1<Cl<0.14mol•L﹣1 |
考点:
化学平衡的计算.
专题:
化学平衡专题.
分析:
A、根据各物质表示的化学反应速率之比等于系数之比来计算;
B、化学平衡状态的标志是:正逆反应速率相等;
C、反应物的转化率和反应物的初始浓度以及变化浓度有关系;
D、极限假设0.08mol/L的氨气全部为生成时,则此时氮气的浓度存在极大值.
解答:
解:A、“达平衡时X、Y的浓度分别为0.1mol/L,0.3mol/L”,则浓度之比是1:3;反应中无论是消耗它们还是生成它们,变化浓度之比肯定也是1:3;末态浓度加消耗掉浓度,所以,起始时也一定是1:3,故A正确;
B、Y的生成速率是V逆,Z的生成速率是V正,同一个反应速率用不同的物质表示时,数值与它们的系数成正比,所以H2和
NH3的生成速率之比为3:2才表示V正=V逆,故B错误;
C、如上A所述,X、Y的起始浓度之比是1:3,消耗浓度之比一定是1:3,所以它们的转化率相等,为1:1,故C错误;
D、如果起始时c3=0,则平衡时Z的浓度0.08mol/L,就是反应生成的,这需要0.04mol/L的X,平衡时X、Y、Z的浓度为
0.1mol/L,所以起始时就应该是0.1+0.04=0.14 mol/L,但是题目已知起始时Z的浓度不等于0,C1的取值范围为
0.04mol•L﹣1<C1<0.14mol•L﹣1,故D正确.
故选AD.
点评:
本题是一道关于化学平衡知识的计算题,考查学生分析和解决问题的能力,综合性强,难度大.


科目:高中化学 来源: 题型:
3I﹣+S2O82﹣=I3﹣+2SO42﹣的反应速率可以用I3﹣与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大.某探究性学习小组在20℃进行实验,得到的数据如下表:
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I﹣)/mol•L﹣1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.160 |
| c(S2O82﹣)/mol•L﹣1 | 0.040 | 0.040 | 0.080 | c1 | 0.080 |
| t/s | 88.0 | 44.0 | 22.0 | 22.0 | t2 |
下列说法不正确的是( )
|
| A. | 该实验的目的是探究I﹣与S2O82﹣浓度对反应速率的影响 |
|
| B. | 若在40℃下进行编号③对应浓度的实验,显色时间的范围为<22.0s |
|
| C. | 实验④c1=0.020 mol•L﹣1 |
|
| D. | 实验⑤显色时间t2=11 s |
查看答案和解析>>
科目:高中化学 来源: 题型:
以下有关元素性质的说法不正确的是( )
|
| A. | 具有下列电子式的原子中,①1s22s22p63s23p2②1s22s22p3③1s22s22p2④1s222s2p63s23p4原子半径最大的是① |
|
| B. | 下列原子的价电子排布中,①3s23p1②3s23p2③3s23p3④3s23p4对应的第一电离能最大是③ |
|
| C. | ①Na,K,Rb②N,P,As③O,S,Se④Na,P,Cl元素的电负性随原子序数增大而递增的是④ |
|
| D. | 某元素的逐级电离能分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )
|
| A. | 标准状况时,22.4L四氯化碳所含有的分子数为NA |
|
| B. | 34g H2O2中含有的非极性共价键数为 NA |
|
| C. | 碱性锌锰电池中,当有1.3g的锌消耗,则转移的电子数为0.002NA |
|
| D. | 将16gO2与64gSO2在一定的条件下充分反应生成的SO3分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
在反应3H2+N2⇌2NH3 中,经一段时间后,氨的浓度增加了0.6mol/L,在此时间内用H2表示的平均反应速率为0.45mol/(L•s),则反应所经过的时间为( )
|
| A. | 0.44s | B. | 1s | C. | 0.33s | D. | 2s |
查看答案和解析>>
科目:高中化学 来源: 题型:
实验探究:探究碳、硅元素的非金属性的相对强弱.根据要求完成下列各小题.
(1)实验装置:
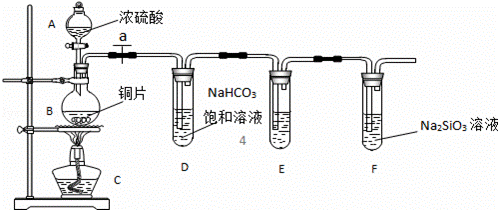
填写所示仪器名称A B
(2)实验步骤:
连接仪器、 、加药品后,打开a、然后滴入浓硫酸,加热.
(3)问题探究:(已知酸性强弱:亚硫酸>碳酸)
①铜与浓硫酸反应的化学方程式是 ;装置E中足量酸性KMnO4溶液(具有强氧化性)的作用是 ;
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是 ;
③依据试管D中的实验现象,能否证明硫元素的非金属性强于碳元素的非金属性 (填“能”或“否”),试管D中发生反应的离子方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物CH3﹣CH═CH﹣Cl不 能发生的反应有( )
①取代反应 ②加成反应 ③消去反应 ④使溴水褪色 ⑤使酸性KMnO4溶液褪色 ⑥与AgNO3溶液生成白色沉淀 ⑦聚合反应.
|
| A. | ①②③④⑤⑥⑦ | B. | ⑦ | C. | ⑥ | D. | ② |
查看答案和解析>>
科目:高中化学 来源: 题型:
向紫色石蕊试液中加入过量的Na2O2粉末,振荡,观察不到的现象是( )
A.有大量气泡产生
B.溶液颜色先变为蓝色
C.最后溶液褪色
D.最后溶液变为蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
在含有FeCl3和BaCl2的酸性溶液中,通入足量的SO2后有白色沉淀生成,过滤后,向溶液中滴加KSCN溶液,无明显现象,下列叙述不正确的是 ( )
A.白色沉淀是BaSO4和BaSO3 B.溶液的酸性增强
C.白色沉淀是BaSO4 D.FeCl3全部被还原为FeCl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com