
| A、正、逆反应速率同时增大,平衡不移动 |
| B、正、逆反应速率同时增大,NH3的百分含量升高 |
| C、正、逆反应速率同时增大,平衡向逆反应方向移动 |
| D、正、逆反应速率不变,平衡不移动 |


科目:高中化学 来源: 题型:
| A、CH4和Cl2以物质的量之比为1:1混合,光照下只生成CH3Cl和HCl |
| B、分子式为C3H5Cl3的同分异构体共有(不考虑立体异构)5种 |
C、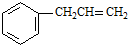 分子中所有原子可以处在同一平面上 分子中所有原子可以处在同一平面上 |
D、单体CH2═CHCH3和CH2═CH2可以通过加聚反应合成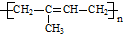 |
查看答案和解析>>
科目:高中化学 来源: 题型:
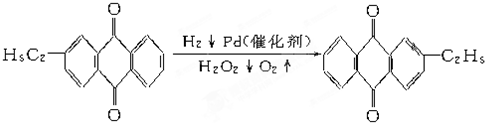
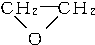 +CaCl2+H2O,则制备
+CaCl2+H2O,则制备 工艺的原子利用率为
工艺的原子利用率为| 44 |
| 44+111+18 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化硫广泛用于食品的漂白 |
| B、生活中使用的塑料食品盒、水杯等通常由聚苯乙烯制成,其单体的分子式为C8H10 |
| C、合成纤维,人造纤维及碳纤维都属于有机高分子材料 |
| D、先通入氯气,再加入硫酸亚铁处理水,能达到消毒杀菌和除去悬浮杂质的目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X、Y、Z的浓度相等 |
| B、X、Y、Z的分子数比为1:3:2 |
| C、Z的生成速率是X的生成速率的二倍 |
| D、单位时间内生成n mol X,同时生成3n mol Y |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生铁、不锈钢和黄金都属于合金 |
| B、水泥、玻璃、陶瓷均属于无机非金属材料 |
| C、淀粉、油脂、蛋白质都属于天然高分子化合物 |
| D、天然气、石油液化气和汽油的主要成分都属于烃类 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NO3-、Al3+、K+ |
| B、SiO32-、AlO2-、K+ |
| C、SO42-、Cu2+、Na+ |
| D、Ba2+、Na+ NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
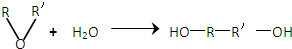
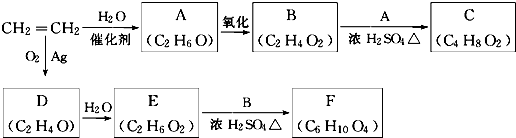
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com