
����Ŀ�������[��NH4)2C2O4] Ϊ��ɫ��״���壬���ȶ� �������ֽ⣬�����ڲⶨ Ca2+��Mg2+�ĺ�����
I.ijͬѧ������ͼ��ʾʵ��װ�ü������淋ķֽ���

��1��ʵ������У��۲쵽���з�̪��Һ����ֽ��죬װ�� B �г���ʯ��ˮ����ǣ�˵���ֽ�����к���__________________���ѧʽ�������۲쵽__________________��˵���ֽ�����к��� CO������立ֽ�Ļ�ѧ����ʽΪ______________________��
��2����Ӧ��ʼǰ ��ͨ�뵪����Ŀ����________________________��
��3��װ�� C ��������_______________________��
��4������һ�ַֽ������һ��������Ҳ�ܻ�ԭCuO , �÷�Ӧ�Ļ�ѧ����ʽΪ__________��
II.��ͬѧ���ò���鱗ⶨѪҺ�и�Ԫ�صĺ��� ��
��5��ȡ 20.00 mL ѪҺ��Ʒ �������� l00m L, �ֱ�ȡ���������Ϊ25.00 mL ϡ�ͺ��ѪҺ��Ʒ���������泥����ɲ���Ƴ��������ˣ����ó������ڹ���ϡ�����У�Ȼ���� 0.0l00mol/L KMnO4 ��Һ���еζ����ζ����յ�ʱ��ʵ������Ϊ___________�����εζ�ʵ������ KMnO4 ��Һ������ֱ�Ϊ0.43mL , 0.41 m L , 0.52mL, ���ѪҺ��Ʒ�и�Ԫ�صĺ���Ϊ________m mol/L��
���𰸡�![]() ��
��![]() װ��E������ͭ�ɺ�ɫ��Ϊ��ɫ��װ��F�г���ʯ��ˮ�����
װ��E������ͭ�ɺ�ɫ��Ϊ��ɫ��װ��F�г���ʯ��ˮ����� 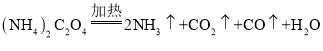 �ž�װ���ڵĿ���������CO�������ϼ��ȷ�����ը������ֹ�����е�
�ž�װ���ڵĿ���������CO�������ϼ��ȷ�����ը������ֹ�����е�![]() ����ʵ�� ����
����ʵ�� ����![]() �������CO�ļ����������
�������CO�ļ���������� 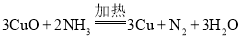 ���������һ��
���������һ��![]() ��Һʱ����Һ����ɫ��Ϊdz��ɫ���Ұ�����ڲ���ɫ 2.10
��Һʱ����Һ����ɫ��Ϊdz��ɫ���Ұ�����ڲ���ɫ 2.10
��������
I���������A�����ȷֽ⣬���������а�����������ˮ��Ӧ���ɰ�ˮ����ˮ�Լ��ԣ�����з�̪��Һ����ֽ��죬ͨ�����ʯ��ˮ��������ʯ��ˮ����ǣ�������ж�����̼����NaOH��Һ��ȥ������̼����Ũ�����ȥˮ���������������������ڱ�죬��F�г���ʯ��ˮ�������֤����������CO��
II�������ӺͲ�����������ɲ���Ƴ���������ƺ����ᷴӦ��������ƺͲ��ᣬ�ø�����صζ�����Ӷ���ӵζ������ӡ�
��.��1��ʵ������У��۲쵽���з�̪��Һ����ֽ��Ϊ��ɫ˵���ֽ�����к��а�����װ��B�г���ʯ��ˮ����ǣ�˵���ֽ�����к��ж�����̼���壬���۲쵽װ��E������ͭ�ɺ�ɫ��Ϊ��ɫ��װ��F�г���ʯ��ˮ����ǣ�˵���ֽ�����к���CO�����Բ���立ֽ������![]() ��
��![]() ��CO��
��CO��![]() ����Ӧ�Ļ�ѧ����ʽΪ
����Ӧ�Ļ�ѧ����ʽΪ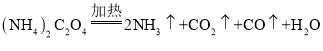 ��
��
��2����Ӧ��ʼǰ��ͨ�뵪����Ŀ�����ž�װ���ڵĿ���������CO�������ϼ��ȷ�����ը������ֹ�����е�![]() ����ʵ��,�ʴ�Ϊ���ž�װ���ڵĿ���������CO�������ϼ��ȷ�����ը������ֹ�����е�
����ʵ��,�ʴ�Ϊ���ž�װ���ڵĿ���������CO�������ϼ��ȷ�����ը������ֹ�����е�![]() ����ʵ�飻
����ʵ�飻
��3��װ��E��F����֤����立ֽ�����к���CO������Ҫ�ѷֽ������![]() ��ȥ�����װ��C�������ǣ�����
��ȥ�����װ��C�������ǣ�����![]() �������CO�ļ���������ţ��ʴ�Ϊ������
�������CO�ļ���������ţ��ʴ�Ϊ������![]() �������CO�ļ���������ţ�
�������CO�ļ���������ţ�
��4������立ֽ������![]() �л�ԭ�ԣ�һ��������Ҳ����CuO��Ӧ���÷�Ӧ�Ļ�ѧ����ʽΪ
�л�ԭ�ԣ�һ��������Ҳ����CuO��Ӧ���÷�Ӧ�Ļ�ѧ����ʽΪ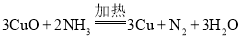 ��
��
��![]() �����Ը��������Һ�ζ���������ӣ���������������ԭ��Ӧ����ɫ�ĸ��������Һ����ɫ���ζ����յ�ʱ��ʵ������Ϊ�����������һ��
�����Ը��������Һ�ζ���������ӣ���������������ԭ��Ӧ����ɫ�ĸ��������Һ����ɫ���ζ����յ�ʱ��ʵ������Ϊ�����������һ��![]() ��Һʱ����Һ����ɫ��Ϊdz��ɫ���Ұ�����ڲ���ɫ���������εζ��������Ը��������Һ�������֪����������һ������������̫�����������������ε�ƽ�����Ϊ
��Һʱ����Һ����ɫ��Ϊdz��ɫ���Ұ�����ڲ���ɫ���������εζ��������Ը��������Һ�������֪����������һ������������̫�����������������ε�ƽ�����Ϊ![]() ������������ԭ��Ӧ�еĵ����غ㼰Ԫ���غ㣬��
������������ԭ��Ӧ�еĵ����غ㼰Ԫ���غ㣬�� �����
�����![]() ������20mLѪҺ��Ʒ�к��еĸ�Ԫ�ص����ʵ���Ϊ
������20mLѪҺ��Ʒ�к��еĸ�Ԫ�ص����ʵ���Ϊ![]() ����
����![]() �����ѪҺ�и�Ԫ�صĺ���Ϊ
�����ѪҺ�и�Ԫ�صĺ���Ϊ![]() ���ʴ�Ϊ�����������һ��
���ʴ�Ϊ�����������һ��![]() ��Һʱ����Һ����ɫ��Ϊdz��ɫ���Ұ�����ڲ���ɫ��
��Һʱ����Һ����ɫ��Ϊdz��ɫ���Ұ�����ڲ���ɫ��![]() ��
��


 ��ʿһ��ȫͨϵ�д�
��ʿһ��ȫͨϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�����ú��������,�����Ȱ�úת��ΪCO��H2���ٽ�����ת��Ϊ�״���ijʵ����Ա��һ���¶���2L���ܱ������У�����һ������H2��CO��������Ӧ��2H2(g)+CO(g)![]() CH3OH(g)���ⶨ�IJ���ʵ���������£�
CH3OH(g)���ⶨ�IJ���ʵ���������£�
t/s | 0 | 500 | 1000 |
c(H2)/ mol.L-1 | 5.00 | 3.52 | 2.48 |
c(CO)/ mol.L-1 | 2.50 |
(1)��500s����H2��ʾ�Ļ�ѧ��Ӧ������________________��
(2)��1000s����CO��ʾ�Ļ�ѧ��Ӧ������________________��1000sʱCO��ת������________��
(3)��500sʱ���ɵļ״���Ũ����________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO��CO2�ǻ�ʯȼ��ȼ�պ����Ҫ���
��1�������������ڰ�װ�Ĵ�ת��������ʹ����β���е���Ҫ��Ⱦ��ת��Ϊ���Ĵ���ѭ�����ʡ���֪��N2(g)��O2(g)===2NO(g)��H=��180.5kJ��mol��1
2C(s)��O2(g)===2CO(g)��H=��221.0kJ��mol��1
C(s)��O2(g)===CO2(g)��H=��393.5kJ��mol��1
��Ӧ2NO(g)��2CO(g)===N2(g)��2CO2(g)����H=________kJ��mol��1��
��2����֪����ӦCO2(g)![]() CO(g)+O(g)���ܱ�������CO2�ֽ�ʵ��Ľ����ͼ1����Ӧ2CO2(g)
CO(g)+O(g)���ܱ�������CO2�ֽ�ʵ��Ľ����ͼ1����Ӧ2CO2(g)![]() 2CO(g)+O2(g)��1molCO2�ڲ�ͬ�¶��µ�ƽ��ֽ�����ͼ2��
2CO(g)+O2(g)��1molCO2�ڲ�ͬ�¶��µ�ƽ��ֽ�����ͼ2��
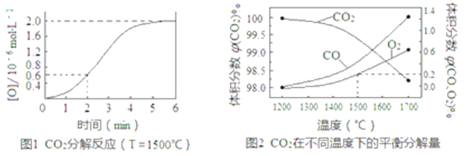
�ٷ���ͼ1����2min��v(CO2)=_______��5minʱ�ﵽƽ�⣬ƽ��ʱc��CO��=_______��
�ڷ���ͼ2��1500��ʱ��Ӧ��ƽ�⣬��ʱ�������Ϊ1L����Ӧ��ƽ�ⳣ��K=______(����������1λС��)��
��3��Ϊ̽����ͬ������CO��H2�ϳ�CH3OH��ѡ����Ч����ijʵ���ҿ���CO��H2�ij�ʼͶ�ϱ�Ϊ1��3����ʵ�飬�õ��������ݣ�
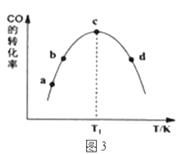
ѡ�� | T/K | ʱ��/min | �������� | �״��ĺ���(%) |
A | 450 | 10 | CuO-ZnO | 78 |
B | 450 | 10 | CuO-ZnO-ZrO2 | 88 |
C | 450 | 10 | ZnO-ZrO2 | 46 |
���ɱ�1��֪���÷�Ӧ����Ѵ���Ϊ____________�����ţ���ͼ3��a��b��c��d�ĵ��Ǹ��¶���CO��ƽ��ת���ʵ���____________��
�����������COת��ΪCH3OH��ƽ��ת���ʵĴ�ʩ��____________��
A��ʹ�ô���CuO��ZnO��ZrO2B���ʵ����ͷ�Ӧ�¶�
C������CO��H2�ij�ʼͶ�ϱ�D�������£��ٳ���amolCO��3amolH2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ����������һ�ݻ���Ϊ2L�������ڷ�����Ӧ��2A(g)+B(g)![]() 2C(g)����֪��ʼͶ��4molA(g) ��2 mol B(g)����2 s����C��Ũ��Ϊ0.6 mol/L������2 s������Ũ�Ȳ��ٸı䡣����˵����ȷ����
2C(g)����֪��ʼͶ��4molA(g) ��2 mol B(g)����2 s����C��Ũ��Ϊ0.6 mol/L������2 s������Ũ�Ȳ��ٸı䡣����˵����ȷ����
A.2 s��������A��ʾ��ƽ����Ӧ����Ϊ0.6 mol/(Ls)
B.2 s��������B��ʾ��ƽ����Ӧ����Ϊ0.6 mol/(Ls)
C.2 s��ÿ��0.6 mol������B���ɣ�ͬʱ����0.6 mol����C����
D.2 sʱ����B��Ũ��Ϊ0.7 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
�̲IJ�ͼ���м������ں��ḻ���ص㡣��ش��������⣺
��1���������ڵ�ij����Ԫ�أ����һ�����������������ͼ1��ʾ�����Ԫ�ض�Ӧ��ԭ����_____�ֲ�ͬ�˶�״̬�ĵ��ӡ�
��2����ͼ2��ʾ��ÿ�����߱�ʾ���ڱ���A ~��A �е�ijһ��Ԫ���⻯��ķе�仯��ÿ��С�ڵ����һ���⻯�����a���������___________���ж�������____________��
��3��CO2�ڸ��¸�ѹ�����γɵľ����侧����ͼ3��ʾ����þ������������_____________���塣

��4����һ�����ܽ���Al��P֮��ĵ�������Ԫ����____�֡� GaCl3������ԭ�ӵ��ӻ���ʽΪ_________��д����GaCl3�ṹ��ͬ��һ�ֵȵ����壨д���ӣ�______________��
��5�������ɱ����ⶼ�Ƿ��Ӿ��壬���Ľṹ���������ԣ����ɱ�����ľ���������ƵĽṹ�������ɱ�������һ��������Χ��__________�����ڷ��ӡ� D�������ξ���ֲ��ṹ��ͼ���þ����к��еĻ�ѧ����_____________������ĸ��ţ���

a�����Լ� b���Ǽ��Լ� c����λ�� d��������
��6��Fe��һ�־�����ס�����ʾ�����������߷������ҵõ���A~Dͼ����ȷ����_____������ĸ��ţ���


��ԭ�ӵ���λ����____________��������ԭ�ӵİ뾶��r cm���þ�����ܶ�����g/cm3 �����������ԭ������Ϊ________________���谢���ӵ�������ֵΪNA����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������㷺Ӧ���ڵ�ơ���ء������ȹ�ҵ��ij����С���Դ�������(��Cu2+��Fe3+��Ca2+��Mg2+��Zn2+��)Ϊԭ�ϣ�����ͼһϵ�г��ӹ���ģ�⾫�����������ա��ش��������⡣

��1������1����Ҫ�ɷ���__(д��ѧʽ)��д������ͭ�������з�����������ԭ��Ӧ�����ӷ���ʽ___��
��2��������������ʱ����Cl2��Ni(OH)2�����÷ֱ���___��
��3����֪25��ʱ��Ksp[CaF2]=3.95��10-11��Ksp[MgF2]=6.40��10-9����������������������Һ3�� =__��(������λ��Ч����)
=__��(������λ��Ч����)
��4������ȡ��ʱʹ����ȡ��R���������ж�ijЩ�������ӵ���ȡ������ҺpH�Ĺ�ϵ��ͼ����ʵ��ʱ����Ƶ�pH���˷�Χ��___(����ĸ���)��
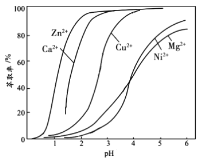
A.1��2 B.3��4 C.4��5 D.5��6
��5������ȡ�����ø�������������Һ������A�ɵ����������壬�����AΪ___��___�����ˡ�ϴ�ӵȡ�
��6����ȡ2.000g����������(NiSO4��6H2O)��Ʒ�ܽ⣬������250mL��ȡ25.00mL��Һ����0.0200mol��L-1��EDTA(Na2H2Y)����Һ�ζ����յ㡣�ظ�ʵ�飬ƽ������EDTA����Һ���Ϊ36.50mL����ӦΪNi2++H2Y2-=NiY2-+2H+��������Ʒ����Ϊ__%��(������λ��Ч����,�Ҳ��������ʷ�Ӧ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������е�һ����������巢����Ӧ��![]() ƽ��ʱ���A��Ũ��Ϊ0.50mol/L,�����¶Ȳ��䣬���������ݻ�����ԭ�����������ٴ�ƽ��ʱ,���A��Ũ��Ϊ0.30mol/L�������й��ж���ȷ����
ƽ��ʱ���A��Ũ��Ϊ0.50mol/L,�����¶Ȳ��䣬���������ݻ�����ԭ�����������ٴ�ƽ��ʱ,���A��Ũ��Ϊ0.30mol/L�������й��ж���ȷ����
A.x+y��zB.ƽ��������Ӧ�����ƶ�
C.B��ת���ʽ���D.C�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������֮�������·�Ӧ��ϵ��
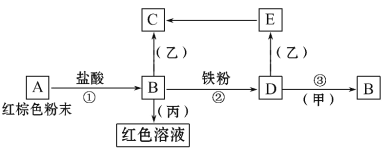
��֪��Eת����C�������ǣ���ɫ����Ѹ�ٱ�Ϊ����ɫ������Ϊ���ɫ���ش�
��1��д���������ʵĻ�ѧʽ��A___��D___����___����___��
��2��д������ɫ��ĩ��һ����;___��
��3��д��E��C��Ӧ�Ļ�ѧ����ʽ___��
��4�������͵�B��Һ�����ˮ�����÷�ɢϵ�з�ɢ�ʿ���ֱ����ΧΪ___��
��5��д����Ӧ�ڵ����ӷ���ʽ___���÷�Ӧ�У������5.6g������ȫ��Ӧ������D�����ʵ���Ϊ___mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС��ͬѧΪ��̽��������ͬ���¶Ⱥ�ѹǿ�£���ͬ������κ����嶼������ͬ��Ŀ�ķ������������Խ̲�����أ���ѧ̽����Ϊ�������������ͼʵ��װ�ò���¼���ʵ�����ݡ�
��ʵ��װ�ã�
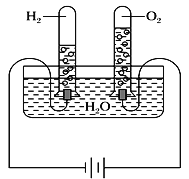
������ʵ�����ݣ�
�¶� | ѹǿ | ʱ�� | ˮ����H2O������ | H2��� | O2��� |
30 �� | 101 kPa | 0 | 300 g | 0 | 0 |
30 �� | 101 kPa | 4���� | 298.2 g | 1.243 L |
��ش��������⣺
(1)4����ʱH2��O2�����ʵ����ֱ���________mol��________mol��
(2)���¶��£�����Ħ�������__________��
(3)�ڸ�ʵ�������£�3 mol O2����������Ϊ____________L
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com