
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
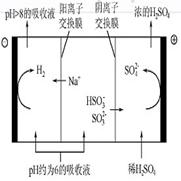
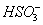 存在;
存在;
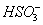 的电离程度强于水解强度
的电离程度强于水解强度
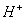 在阴极得电子生成
在阴极得电子生成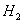 ,溶液中
,溶液中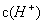 降低,促使
降低,促使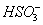 电离生成
电离生成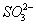 ,且
,且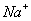 进入阴极室,使吸收液再生
进入阴极室,使吸收液再生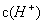 降低,促使
降低,促使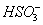 电离生成
电离生成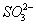 ,且
,且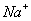 进入阴极室,使吸收液得以再生并循环使用。
进入阴极室,使吸收液得以再生并循环使用。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
 CH3COO- +H+下列说法正确的是( )
CH3COO- +H+下列说法正确的是( )| A.加水稀释,中和此溶液所需的0.1mol/LNaOH溶液的体积增大 |
| B.加入固体碳酸钠,平衡正向移动,c(CH3COOH)减小 |
| C.加入固体醋酸钠,平衡逆向移动,c(H+)、c(CH3COO-)均减小 |
| D.加水稀释,电离程度增大,由CH3COOH电离出来的n(H+)增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.醋酸溶液能和碳酸钠反应生成CO2和水 |
| B.25℃时,测得0.1mol.L-1醋酸钠溶液的pH约为8 |
| C.25℃时,测得0.1mol.L-1醋酸溶液的pH约为3 |
| D.同温,同浓度、同体积的稀盐酸和稀醋酸分别与足量的锌粒反应,两者生成氢气一样多,但盐酸的反应比醋酸快 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1 mol/L 硫酸溶液中H+浓度为2 mol/L |
| B.能跟锌反应产生氢气 |
| C.能使石蕊试液变红 |
| D.能与碳酸钠反应放出二氧化碳气体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 醋酸溶液加水稀释,下列说法正确的是()
醋酸溶液加水稀释,下列说法正确的是()| A.溶液中c(H+)和c(OH-)都减小 | B.溶液中c(H+)增大 |
| C.醋酸电离平衡向左移动 | D.溶液的pH增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com