
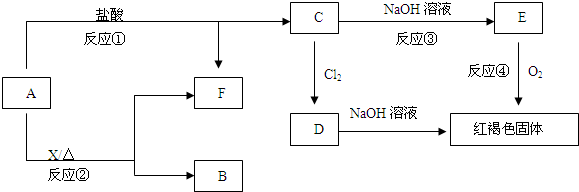
 类反应的名称是
类反应的名称是
| ||
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
| ② | |||
| ⑦ | ⑧ |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
A.上述三个反应都有单质生成,所以都是置换反应
B.氧化性由强到弱的顺序为KBrO3>KClO3>Cl2>Br2
C.反应①中还原剂与氧化剂的物质的量之比为1:6
D.若反应②中有1 mol还原剂参加反应,则氧化剂得电子的物质的量为2mol
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
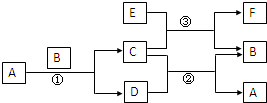 右图中所涉及的A、B、C、D、E、F和G都是中学化学教材中常见的物质.E为铝;B、D为单质,其余为化合物;反应①②③均在高温下进行且均为置换反应;A在常温下为液态,C有磁性,E、F既能溶于NaOH又能溶于HCl.
右图中所涉及的A、B、C、D、E、F和G都是中学化学教材中常见的物质.E为铝;B、D为单质,其余为化合物;反应①②③均在高温下进行且均为置换反应;A在常温下为液态,C有磁性,E、F既能溶于NaOH又能溶于HCl.查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)有①、②、③、④、⑤、⑥、⑦、⑧、⑨、⑩十种元素,原子序数依次增大,⑨、⑩处于第四周期,其余均为短周期元素。
(1) 若②、⑦、⑧三种元素在周期表中相对位置如下:
② |
|
|
|
|
| ⑦ | ⑧ |
②与⑦、②与⑧形成的液体化合物是常见的重要溶剂,则②、⑦、⑧三种元素最高价氧化物对应的水化物酸性由强到弱的顺序是: (用化学式表示)。
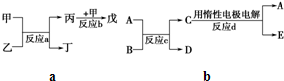
(2)若甲、乙、丙、丁、戊均为上述八种短周期元素中的某些元索组成的单质或由其中两种元素组成的化合物,且甲、戊为无色气体,反应a为置换反应,反应b为化合反应。见右图示转化关系推测:戊可能为: (列举合适的一例)。
 |
![]()
![]()
![]()
![]()
若甲是O2、乙是N2H4,反应a是在强碱性溶液中进行的的原电池反应,则负极发生的电极反应式为:
。
![]() (3)若右下图中A、B、C、D、E分别是上述10种元素中的某些元素组成的单质或其中两种元素组成的化合物.已知:A是常见的金属单质,反应c为置换反应类型。若反应c是用A作电极,在B的水溶液中进行电解反应,它们有如右图示转化关系。则反应d中阴极的电极反应式为:
(3)若右下图中A、B、C、D、E分别是上述10种元素中的某些元素组成的单质或其中两种元素组成的化合物.已知:A是常见的金属单质,反应c为置换反应类型。若反应c是用A作电极,在B的水溶液中进行电解反应,它们有如右图示转化关系。则反应d中阴极的电极反应式为:![]() 。
。
![]() 若反应c是在高温下进行的,且为工业上有重要应用价值的放热反应,当物质C是一种两性化合物,则反应c的化学方程式: 。
若反应c是在高温下进行的,且为工业上有重要应用价值的放热反应,当物质C是一种两性化合物,则反应c的化学方程式: 。
 |
![]()
![]()
![]()
查看答案和解析>>
科目:高中化学 来源:2009-2010学年山东省东营市东营区胜利一中高三(上)模块检测化学试卷(必修2)(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com