
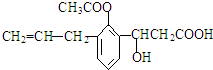
 ,则此有机物可发生的反应类型有:( )①取代 ②加成 ③酯化 ④水解 ⑤氧化 ⑥中和.
,则此有机物可发生的反应类型有:( )①取代 ②加成 ③酯化 ④水解 ⑤氧化 ⑥中和.| A. | ①②④⑤⑥ | B. | ②③④⑤ | C. | ①②③④⑤⑥ | D. | ②③④⑤⑥ |
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 其单质在常温下为白色固体 | |
| B. | 原子的最外电子层上有7个电子 | |
| C. | 其最高价氧化物对应水化物一定为强酸 | |
| D. | 其元素位于元素周期表中第五周期第 VII族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的16种兴奋剂.已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如右图所示.下列叙述中正确的是( )
为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的16种兴奋剂.已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如右图所示.下列叙述中正确的是( )| A. | 该物质可以视为烃类 | B. | 该有机物的分子式为C20H32O | ||
| C. | 不能使溴的四氯化碳溶液褪色 | D. | 该物质分子中的所有碳原子均共面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
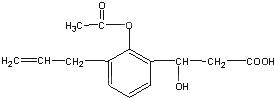 某有机物的结构简式如图:则此有机物可发生的反应有( )①取代 ②加成③氧化④酯化 ⑤水解⑥中和.
某有机物的结构简式如图:则此有机物可发生的反应有( )①取代 ②加成③氧化④酯化 ⑤水解⑥中和.| A. | ①②③⑤ | B. | ②③④⑤ | C. | ①②③④⑤ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
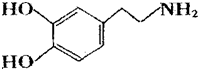
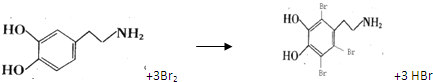 .
.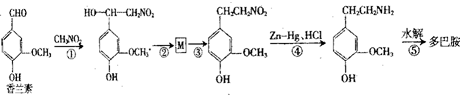
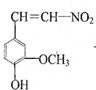 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | 2使溴的四氯化碳溶液褪色; ②比例模型为  ③能与水在一定条件下反应生成C |
| B | 2C、H两种元素组成; ②球棍模型为  |
| C | ①由C、H、O三种元素组成; ②能与Na反应; ③与E反应生成相对分子质量为88的酯 |
| D | ①相对分子质量比C少2; ②能由C催化氧化得到 |
| E | ①由C、H、O三种元素组成;②其水溶液能使紫色石蕊试液变红; ③可由C发生氧化反应得到 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
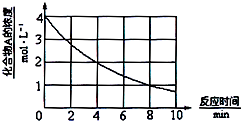 化合物A在一定条件下发生分解反应,反应物浓度随反应时间的变化如图所示.则化合物A在4~8min间的平均反应速率为( )
化合物A在一定条件下发生分解反应,反应物浓度随反应时间的变化如图所示.则化合物A在4~8min间的平均反应速率为( )| A. | 0.20mol•L-1•min-1 | B. | 0.25mol•L-1•min-1 | ||
| C. | 0.30mol•L-1•min-1 | D. | 0.50mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性:F>O>S | B. | 稳定性:PH3>H2S>HCl | ||
| C. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | D. | 酸性:HClO4>HBrO4>HIO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com