
 ,
, .若用球棍模型表示①和④形成的化合物的分子结构,应该是下图中的B.
.若用球棍模型表示①和④形成的化合物的分子结构,应该是下图中的B.
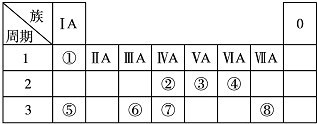
分析 由元素在周期表中的位置可知:①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为Si,⑧为Cl.
(1)同周期自左而右金属性减弱,同主族自上而下金属性增强;元素最高价氧化物对应的水化物中酸性最强的酸是高氯酸;
(2)元素⑧的最高价氧化物对应的水化物为HClO4,与氢氧化钠反应生成NaClO4与水;
(3)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
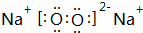
(4)①、④、⑤中的某些元素可形成既含离子键又含极性共价键的化合物有:NaOH、Na2O2;
①和④形成的化合物为H2O等,水分子中O氧原子与H原子之间形成1对共用电子对,为V形结构;
(5)w是第四周期与③同主族的元素,则w为As;
A.主族元素最高正化合价等于最外层电子数;
B.非金属性越强,气态氢化物越稳定;
C.非金属性越强,最高价氧化物的水化物的酸性越强;
D.非金属性越强,单质与氢气反应越容易;
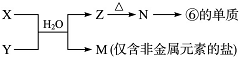
(6)M是仅含非金属的盐,所以M一定是铵盐,Z→N→⑥的单质,⑥为Al,推断N是氧化铝,Z是氢氧化铝,根据产物结合反应:X+Y+H2O→Al(OH)3+NH4+ 可知,该反应为铝盐和一水合氨的反应.
解答 解:由元素在周期表中的位置可知:①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为Si,⑧为Cl.
(1)同周期自左而右金属性减弱,同主族自上而下金属性增强,故上述元素中Na的金属性最强;元素最高价氧化物对应的水化物中酸性最强的酸是HClO4,故答案为:Na;HClO4;
(2)元素⑧的最高价氧化物对应的水化物为HClO4,与氢氧化钠反应生成NaClO4与水,反应离子方程式为:H++OH-=H2O,故答案为:H++OH-=H2O;
(3)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Na>Si>N,
故答案为:Na>Si>N;
(4)①、④、⑤中的某些元素可形成既含离子键又含极性共价键的化合物有:NaOH、Na2O2,电子式分别为 、
、 ;
;
①和④形成的化合物为H2O等,水分子中O氧原子与H原子之间形成1对共用电子对,为V形结构,图象中B符合,
故答案为: 、
、 ;B;
;B;
(5)w是第四周期与③同主族的元素,则w为As;
A.原子最外层电子数为,主族元素最高正化合价等于最外层电子数,最高正化合价为+5,故正确;
B.同主族自上而下非金属性减弱,故非金属性N>As,非金属性越强,气态氢化物越稳定,故NH3较稳定
,故错误;
C.非金属性越强,最高价氧化物的水化物的酸性越强,故硝酸酸性较强,故正确;
D.As的非金属性较弱,常温下不能与氢气反应,故错误,
故选:BD;
(6)M是仅含非金属的盐,所以M一定是铵盐,Z→N→⑥的单质,⑥为Al,推断N是氧化铝,Z是氢氧化铝,根据产物结合反应:X+Y+H2O→Al(OH)3+NH4+ 可知,该反应为铝盐和一水合氨的反应,则:
X溶液与Y溶液反应的离子方程式为:Al3++3NH3+3H2O=Al(OH)3↓+3NH4+,M中的阳离子为NH4+,鉴定NH4+的方法是:取样品于试管中,加入氢氧化钠溶液,加热,产生使湿润的红色石蕊试纸变蓝的刺激性气味气体,说明含有NH4+,
故答案为:Al3++3NH3+3H2O=Al(OH)3↓+3NH4+;取样品于试管中,加入氢氧化钠溶液,加热,产生使湿润的红色石蕊试纸变蓝的刺激性气味气体,说明含有NH4+.
点评 本题考查元素周期表与元素周期律、元素化合物推断等,侧重对元素周期律与化学用语的考查,注意对元素周期表的整体把握,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 苯、苯的同系物均不能使酸性KMnO4溶液褪色 | |
| B. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| C. | 芳香烃可以来自于煤干馏产品中的煤焦油 | |
| D. | 乙醇、乙酸均能与Na反应放出H2,二者分子中官能团相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
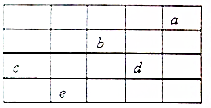 如图所示,a、b、c、d、e为周期表前4周期的一部分元素,下列叙述正确的是( )
如图所示,a、b、c、d、e为周期表前4周期的一部分元素,下列叙述正确的是( )| A. | b元素除0价外,只有一种化合价 | |
| B. | 五种元素中,c元素的天然氧化物可被称为刚玉 | |
| C. | b、d气态氢化物溶于水,溶液的酸性:b>d | |
| D. | c、d气态氢化物的稳定性:d>c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加水稀释,氨水溶液中导电粒子的数目减少 | |
| B. | 通入HCl气体,氨水溶液中NH3•H2O的电离平衡向右移动,溶液的pH增大 | |
| C. | 由0.1mol/L一元碱BOH溶液的 pH=10,可推知BOH溶液中存在BOH═B++OH- | |
| D. | 由0.1mol/L一元酸HA溶液的 pH=3,可推知NaA溶液中存在A-+H2O═HA+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内生成n mol的AB的同时,生成n mol的A2 | |
| B. | 单位时间内生成n mol A2的同时,生成n mol的B2 | |
| C. | 容器内的总压强不随时间而变化 | |
| D. | 单位时间内生成2n mol AB的同时,生成n mol的B2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
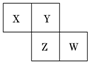 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )| A. | 最高价氧化物对应水化物的酸性W比Z弱 | |
| B. | 只由这四种元素不能组成有机化合物 | |
| C. | Z的单质与氢气反应较Y剧烈 | |
| D. | X、Y形成的化合物都易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,11.2LCI2含有的分子数为NA | |
| B. | 32gO2中所含有的氧原子数为NA | |
| C. | 2.4g镁变成镁离子,转移的电子数为0.2NA | |
| D. | 1L0.3mol/LK2SO4溶液中含有的K+数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纤维素和淀粉遇碘水均呈蓝色 | |
| B. | 油脂可用来制造肥皂 | |
| C. | 石油分馏得到的汽油是纯净物 | |
| D. | 煤的气化属于物理变化,煤的干馏属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E五种物质(或离子)均含有同一种元素,它们之间有如图所示的转化关系:
A、B、C、D、E五种物质(或离子)均含有同一种元素,它们之间有如图所示的转化关系:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com