
| A. | 消耗盐酸一样多 | B. | 放出CO2一样多 | ||
| C. | 消耗盐酸前者多 | D. | 放出的CO2,第一份为第二份的一半 |
分析 发生如下反应2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,Na2CO3+2HCl═2NaCl+CO2↑+H2O;NaHCO3+HCl═NaCl+H2O+CO2↑,设碳酸氢钠为2mol,第一份加热生成二氧化碳的物质的量:1mol的二氧化碳,与盐酸反应生成二氧化碳的量为1mol,消耗盐酸为2mol;而第二份,生成二氧化碳为2mol,消耗盐酸为2mol,由此分析解答.
解答 解:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,Na2CO3+2HCl═2NaCl+CO2↑+H2O;NaHCO3+HCl═NaCl+H2O+CO2↑,设碳酸氢钠为2mol,第一份加热生成二氧化碳的物质的量:1mol的二氧化碳,与盐酸反应生成二氧化碳的量为1mol,消耗盐酸为2mol;而第二份,生成二氧化碳为2mol,消耗盐酸为2mol,所以消耗盐酸一样多,放出二氧化碳分别是1mol和2mol,
故选AD.
点评 本题考查化学方程式的计算,设固体的量为特殊的值进行计算,则简单方便,与盐酸的反应情况,侧重考查学生的分析理解能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 1.5g-CH3中含有的电子数为6.02×1023 | |
| B. | 标准状况下.22.4L NO和11.2L O2混合后气体的分子总数为1.0×6.02×1023 | |
| C. | 工业上用电解法精炼粗铜时,每转移1mo1电子,阳极上溶解的铜原子数必为0.5×6.02×1023 | |
| D. | VL amo1•L-1氯化铁溶液中,若Fe3+的数目为6.02×1023,则Cl-的数目大于3×6.02×1023. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
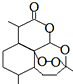 1971年,中国科学家发现、分离、提纯了用于治疗疟疾的“青蒿素”,拯救了数千万人的生命.屠呦呦起了重要的作用,因而与另两位外国科学家获得2015年诺贝尔医学奖.青蒿素分子结构如图.下列说法错误的是( )
1971年,中国科学家发现、分离、提纯了用于治疗疟疾的“青蒿素”,拯救了数千万人的生命.屠呦呦起了重要的作用,因而与另两位外国科学家获得2015年诺贝尔医学奖.青蒿素分子结构如图.下列说法错误的是( )| A. | 青蒿素可以起取代反应 | B. | 青蒿素中的氧均为-2价 | ||
| C. | 青蒿素可以和NaOH溶液反应 | D. | 青蒿素的分子式为C15H22O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(NaOH)=0时,c(H+)=1×10-2 mol/L | |
| B. | V(NaOH)=10mL时,c(H+)=1×10-7 mol/L | |
| C. | V(NaOH)<10mL时,可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) | |
| D. | V(NaOH)>10mL时,c(C2O42-)>c(Na+)>c(HC2O4-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10B的质子数是10 | B. | 10B的中子数与核外电子数不同 | ||
| C. | 10B20是一种新合成的化合物 | D. | 10B20具有较强的化学活性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 | 实验结论 | |
| 步骤① | 取适量NaOH固体放入烧杯中,加入适量的水,搅拌,插入一支温度计 测量溶液温度, | 溶液温度比室 温明显升高 | 氢氧化钠 固体溶于 水放热 |
| 步骤② | 步骤①所得的溶 液冷却到室温,用胶头滴管将稀盐酸滴入到步骤①所得的溶液中 | 溶液温度比室 温明显升高 | 氢氧化钠与稀盐 酸反应会放出热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com